
题目列表(包括答案和解析)
(12分)I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应。向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。
![]()
![]() 乙组: Cu CuO CuSO4
乙组: Cu CuO CuSO4
![]()
![]()
![]() 丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
![]() 丁组: Cu CuSO4
丁组: Cu CuSO4
(1)甲组实验用一个化学反应方程式表示: ;
使反应变快的可能原因是 ;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为 、
过滤并洗涤晶体,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在四组方案中, 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:
CuSO4![]() CuO+SO2↑+SO3↑+O2↑
CuO+SO2↑+SO3↑+O2↑
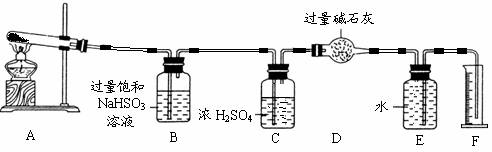 为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;
②实验结束时干燥管D总质
量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
(3)装置B的作用是 。
(4)装置C的作用是 。
(5)为减少测量气体体积引起的误差,应注意的事项有:
① 装置内气体的温度应恢复到室温,
② 调节量筒使其液面与E装置中的液面持平,
③ 。
(6)通过计算,推断出该条件下反应的化学方程式
(12分)反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
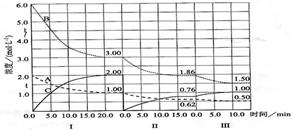
回答问题:
(1)反应的化学方程式中,a:b:c为 ;
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为 ;
(3) B的平衡转化率aI(B)、aII(B)、aIII(B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第II阶段反应温度(T1)和第III阶段反应速度(T3)的高低:T2 T3
填“>、=、<”判断的理由是 ;
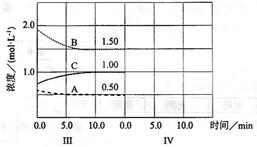
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
(12分) 由几种盐溶于水中形成的一瓶澄清的溶液,其中可能含有NH4+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cu2+、Cl-、Br-、I-、NO3-、CO32-、SO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,pH试纸呈红色。排除 离子的存在。
(2)取出部分溶液,加入少量CCl4及几滴新制氯水,经振荡CCl4层呈紫红色。排除
离子存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除 离子的存在。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。证明
离子存在,又排除 离子存在。
(5)根据上述实验事实能否确定NH4+是否存在,若能,请简述理由 ,若不能,请简述检验它的方法 。
(6)原溶液一定存在的离子有 ,不能确定的离子有 。
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键(填“离子”或“极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红 褐色
褐色
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com