
题目列表(包括答案和解析)
A.用铜作电极电解硫酸铜溶液的离子方程式:2Cu2++2H2O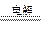 4H++2Cu+O2↑ 4H++2Cu+O2↑ |
| B.含氢氧化钠20.0 g的稀溶液与足量盐酸反应放出28.7 kJ的热量,热化学方程式:NaOH(aq)+ HCl(aq)====NaCl(aq)+H2O(l)ΔH="-28.7" kJ·mol-1 |
C.碳酸氢钙溶液中加入过量饱和氢氧化钙溶液的离子方程式:Ca2++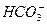 +OH-====CaCO3↓+H2O +OH-====CaCO3↓+H2O |
D.稀硝酸与过量铁粉反应的离子方程式:3Fe+8H++2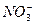 ====3Fe3++2NO↑+4H2O ====3Fe3++2NO↑+4H2O |
(13分)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、 -3 | +7、 -1 | +5、 -3 | -2 |
| A.③、④处于不同周期 |
| B.⑥在同主族元素中非金属性最强 |
| C.⑤元素与⑦元素两者核电荷数之差是8 |
| D.①与⑧形成的化合物只含有离子键 |
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、 -3 | +7、 -1 | +5、 -3 | -2 |
| A.③、④处于不同周期 |
| B.⑥在同主族元素中非金属性最强 |
| C.⑤元素与⑦元素两者核电荷数之差是8 |
| D.①与⑧形成的化合物只含有离子键 |
(15分)有关元素A.B.C.D的信息如下:
| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)乙分子的空间构型________,用电子式表示乙的形成过程____________________。
(2)有关C与D元素,下列说法正确的是____________________ (填序号)。
①C或D的高价盐均可用做净水剂
②用C或D单质做成的槽车,都可用来运输甲的稀溶液
③C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是________________________________________。
(4)现取1 mol/L 100 mL的C的氯化物溶液,向其中加入1 mol/L氢氧化钠溶液产生了3.9 g的沉淀,则加入的氢氧化钠溶液体积可能是____________________mL。
(5)已知:2AB2(g) A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
(15分)有关元素A.B.C.D的信息如下:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
 可能是____________________mL。
可能是____________________mL。 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
 ① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com