
题目列表(包括答案和解析)
实验室制备溴乙烷(C2H5Br)的原理为C2H5OH+NaBr+H2SO4![]() NaHSO4+C2H5Br+H2O,装置如图(已知溴乙烷的沸点38.4℃)和步骤如下:
NaHSO4+C2H5Br+H2O,装置如图(已知溴乙烷的沸点38.4℃)和步骤如下:
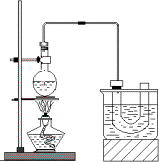
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②在圆底烧瓶中加入研细的13 g溴化钠和几粒碎瓷片,然后加入10 mL 95%乙醇、28 mL 78%浓硫酸;③小心加热,使其充分反应.
回答下列问题:
(1)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是________.
(3)U型管内可观察到的现象是________.
(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的________(填序号).
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是________(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗、分液,然后向油层中加入无水CaCl2,再进行________(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后________(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
溴乙烷是重要的化工原料,实验室制取溴乙烷(沸点为38.4℃)的原理及步骤如下:
(1)反应原理
C2H5OH+NaBr+H2SO4![]() NaHSO4+C2H5Br+H2O
NaHSO4+C2H5Br+H2O
(2)主要反应装置如图:
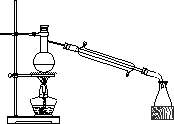
(3)操作步骤
①在100 mL的圆底烧瓶中加入10 mL 95%的乙醇.28 mL 78%的硫酸,然后加入研细的13 g溴化钠.
②加入几块碎瓷片,小心摇动烧瓶使其混合均匀.将烧瓶与直形冷凝管相连,冷凝管下端连接尾接管.
③小心加热,使其充分反应,再进行蒸馏,直到无溴乙烷流出为止.
④再将锥形瓶中的液体冷却后倒入亚硫酸钠溶液中洗涤分液.
试回答下列问题:
(1)本实验中用的是78%的硫酸,为何不用浓硫酸?________.
(2)亚硫酸钠溶液的作用是________.
(3)该实验中会发生许多生成有机物的副反应,写出有关化学方程式________(举两例)
(4)本实验只收集到5 mL溴乙烷,比理想产量约10 mL少,原因是溴乙烷易挥发,为了减少其损失,你认为可采取什么措施?________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com