
题目列表(包括答案和解析)
合成洗涤剂与肥皂的比较,其中错误的是( )
A.肥皂不适合在硬水中使用,而洗涤剂使用不受限制;
B.合成洗涤剂洗涤能力强,不可以用于机洗;
C.合成洗涤剂的原料便宜。
D.合成洗涤剂的危害:由于其稳定性,在自然界中不易被细菌分解,造成水体污染。尤其含磷洗涤剂造成水体富营养
合成洗涤剂与肥皂的比较,其中错误的是
A.肥皂不适合在硬水中使用,而洗涤剂使用不受限制;
B.合成洗涤剂洗涤能力强,不可以用于机洗;
C.合成洗涤剂的原料便宜。
D.合成洗涤剂的危害:由于其稳定性,在自然界中不易被细菌分解,造成水体污染。尤其含磷洗涤剂造成水体富营养。

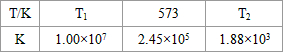
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
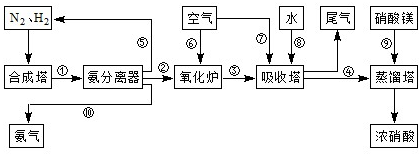
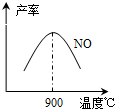 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com