
题目列表(包括答案和解析)
(8分)如图所示,已知A、D、E、F是中学常见的单质,B、C是氧化物,且B是红棕色固体,请填空:
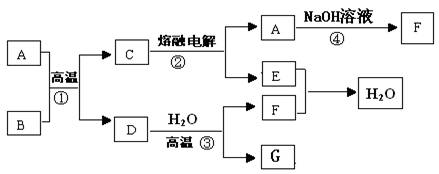
(1)A 是 , B是 。(填化学式)
(2)写出反应③的化学方程式为 。
(3)写出反应④的化学方程式为 。
(4)C电解时,每生成1molA ,同时生成 molE。
(本题共8分)在玻璃生产中,熔炉里原料发生的主要反应为:
2Na2CO3+CaCO3+3SiO2 2Na2SiO3+CaSiO3+3CO2↑
2Na2SiO3+CaSiO3+3CO2↑
(1).某反应物在熔融状态下不导电,它属于_____晶体。
(2).上述反应里,在周期表中相邻两元素的原子半径______>______(填元素符号) ,处于同一周期元素的名称是__________________。
(3).上述反应里金属性最强的短周期元素,其原子核外有______种不同能级的电子,其单质在O2中充分燃烧, 产物的电子式为_____________。
(4).H2与O2发生反应的过程用模型图示如下(“—”表示化学键):

其中过程Ⅰ是______过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的__________分子(填“极性”或“非极性”)。
(8分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性分析:如图甲可通过观察___________________________________定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式:
_____________________________________________________。
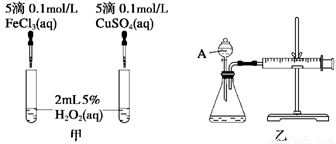
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O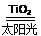 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O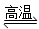 CO+3H2
CO+3H2
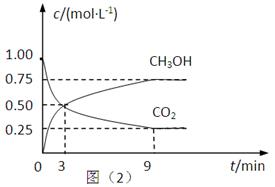
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
|
温度/℃ |
0 |
100 |
200 |
300 |
400 |
|
平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
下列说法正确的是_____。
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(8分)由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
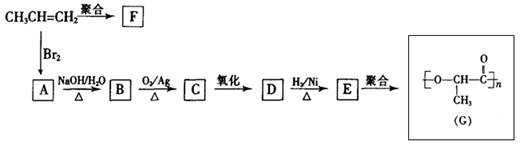
(1)聚合物F的结构简式是 。
(2)D的结构简式是 。
(3)B转化为C的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com