
题目列表(包括答案和解析)
已知反应 ①、② 是化工生产中的两个重要反应:
① 甲溶液 ![]() A + B + C
A + B + C
② 乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是 。
(2)将A通入B的溶液中,反应的离子方程式是 。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是 。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是 。
(5)化工生产②中第二步、第三步用到的设备名称分别为 、 。第二步采用的反应条件为 。
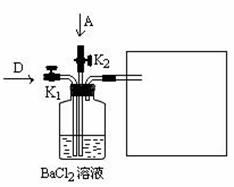
(6)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是 。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是 。
以黄铁矿为原料生产硫酸的工艺流程图如下:
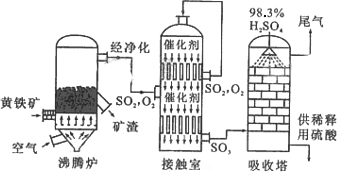
(1)请写出沸腾炉中黄铁矿燃烧的化学方程式:________________.
(2)接触室中2SO2(g)
+O2(g)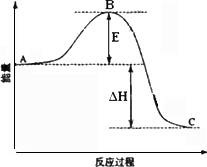
①依据工艺流程图判断下列说法正确的是(选填序号字母)________.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
②反应达到平衡时,平衡常数表达式K=________,升高温度,K值________(填“增大”、“减小”或“不变”);图中△H=________KJ·mol-1.
③图中C点表示________,E的大小对该反应的反应热________(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点________(填“升高”或“降低”).
④如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=________mol·L-1·min-1;
⑤已知单质硫的燃烧热为-296 KJ·mol-1,计算由S(s)生成3 mol SO3(g)的△H=________.
(3)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是________________.
 2SO3(g)△H=-98.3kJ?mol-1
2SO3(g)△H=-98.3kJ?mol-1 O2?SO3 △H=-98.3kJ?mol-1放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)______千焦能量(H2SO4的摩尔质量为98g?mol-1)
O2?SO3 △H=-98.3kJ?mol-1放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)______千焦能量(H2SO4的摩尔质量为98g?mol-1)| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com