工业上由FeS
2制H
2SO
4的转化关系如下:
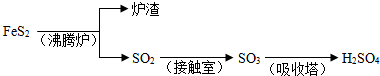
填写下列空白:
(1)已知吸收塔中每40gSO
3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
;
(2)接触室内发生的反应为:
SO
2(g)+
O
2(g)
SO
3(g)△H=a kJ?mol
-1下表为不同温度(T)下该反应的化学平衡常数(K):
| T/K |
673 |
723 |
823 |
923 |
| K |
423 |
37.4 |
20.5 |
4.68 |
①根据上表数据及化学平衡理论,上述反应中a
<
<
0(填“>”或“<”);
②K值越大,表明反应达到平衡时
C
C
(填标号).
A.SO
2的转化率一定越高 B.SO
3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe
2O
3制FeSO
4的方案中,最能体现绿色化学理念的方案是
B
B
(填标号);
A.Fe
2O
3Fe
FeSO
4;B.Fe
2O
3Fe
2(SO
4)
3FeSO
4;C.Fe
2O
3Fe
FeSO
4(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成
4
4
个实验然后进行对比得出结论;
(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO
2的体积分数为0.200%)并吸收SO
2,得到石膏(CaSO
4?2H
2O).求:22.4m
3(标准状况下)的尾气可制得石膏
0.28
0.28
千克;(取两位有效数字)(设二氧化硫的利用率为80.0% )
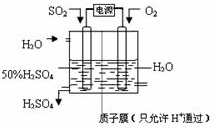
(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
,总反应的化学方程式为
2SO2+O2+2H2O=2H2SO4
2SO2+O2+2H2O=2H2SO4
.