
题目列表(包括答案和解析)
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:

(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
(共5分,每空1分)测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。测定温度______室温(填高于、低于或等于),其理由是 。 将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a︰b 。
(2)若所得混合液的pH=2,则a︰b 。
(8分,每空2分)
(1)N原子的摩尔质量是_______ __, 1mol HNO3约含有_________ 个氧原子(用NA表示)。
(2)实验室中以下述反应制取氯气:4HCl(浓)+MnO2=MnCl2+Cl2↑+2H2O 在该反应中浓盐酸的作用为 , 若在标准状况下制得11.2L氯气则转移的电子总数为 摩尔。
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表: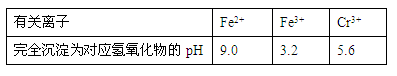
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
(8分,每空2分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)写出与H2O分子互为等电子体的微粒___ ___(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+)。下列对上述过程的描述不合理的是 ( )
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
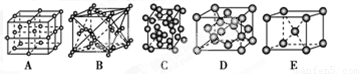
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是________(请用相应的编号填写)。
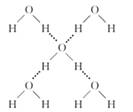
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如下图所示),已知冰的升华热是51 kg/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_____ ___kJ/mol;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com