
题目列表(包括答案和解析)
| ||

工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是: 
2FeSO4 Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、(II)x溶液、(III)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
| A.(I)中会生成BaSO3、BaSO4两种沉淀 |
| B.可将(I)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C.(III)的作用是检验生成的SO2气体 |
| D.(II)所盛x应为品红溶液 |
![]()
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)?

请回答相关问题:?
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是________,发生反应的离子方程式为________________________。
(2)B瓶所盛的试剂的作用是________________;C瓶?所盛试剂的作用是________________。
(3)A瓶要用冷水冷却的原因是________________________。?
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理________(填“合理”“不合理”),理由是________________________。?
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:________。
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来。
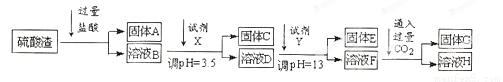
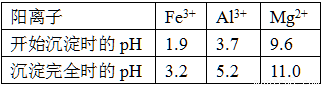
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)工业上用固体A作原料制取粗硅的化学方程式为 。
(2)实验室用11.9mol/L的浓盐酸配制250mL3.0 mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要 。
(3)上述流程中的试剂Y最好选用下列中的 (选填字母编号)。
A.水 B.氧化镁 C.氨水 D.氢氧化钠
(4)写出反应F→H的离子方程式 。
(5)溶液H显碱性,原因是 (用离子方程式和必要的文字说明)。
(6)实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→ ,装置C中应 盛放的试剂为 。
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:

2FeSO4 Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、(II)x溶液、(III)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
A.(I)中会生成BaSO3、BaSO4两种沉淀
B.可将(I)中的BaCl2溶液改为Ba(NO3)2溶液
C.(III)的作用是检验生成的SO2气体
D.(II)所盛x应为品红溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com