
题目列表(包括答案和解析)
用砂纸擦后的镁带丐沸水反应,再向反应后溶液中滴加酚酞溶液向新制的H2S饱和溶液中滴加新制的氯水钠与润滴有酚酞的冷水反应镁带与2mol·L-1盐酸反应铝条与2mol·L-1盐酸反应向ALCI3溶液中滴加NaOH溶液至过量
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
(10分)晶体硅是一种重要的非金属材料。请写出晶体硅的二种用途:______、______
制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知:Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___________。
Ⅱ.SiHCl3在空气中自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)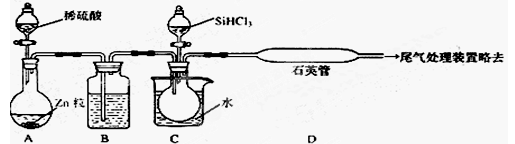
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是______________,
②反应一段时间后,装置D中观察到的现象是 _ ,
装置D中发生反应的化学方程式为 ___ ,
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度
以及 _____________ ,
④设计鉴定产品硅中是否含少量Fe单质的方法:_________________________________。
(10分)晶体硅是一种重要的非金属材料。请写出晶体硅的二种用途:______、______
制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知:Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___________。
Ⅱ.SiHCl3 在空气中自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)
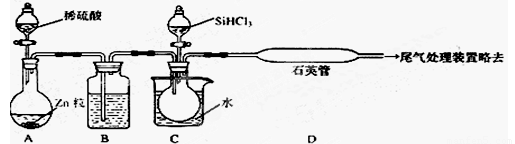
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是______________,
②反应一段时间后,装置D中观察到的现象是 _ ,
装置D中发生反应的化学方程式为 ___ ,
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度
以及 _____________ ,
④设计鉴定产品硅中是否含少量Fe单质的方法:_________________________________。
(10分)有一瓶浅绿色的硫酸亚铁晶体,由于保存不善,导致它在空气中敞口放置了较长的时间,因此该晶体可能被氧化。试用实验证明它是未被氧化或部分被氧化还是全部被氧化,并完成实验报告。
(1)实验目的: 。
(2)实验步骤:
①取少量该晶体溶于水,加酸酸化;
②将溶液分成两份,并置于洁净的试管中,向其中一份溶液中滴加几滴KSCN溶液;
③向另一份溶液中滴加少量的KMnO4溶液。
(2)第①步用酸酸化可以用下列的酸是
A.稀硝酸 B.盐酸 C.浓硫酸 D.稀硫酸
(3)结论:
① ,则说明部分被氧化。
② ,则说明全部被氧化。
③写出硫酸亚铁溶液在酸性条件被氧化的离子反应方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com