
题目列表(包括答案和解析)
(10分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
(2)CCl4分子中C原子采取 杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。
(14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴写出铬的原子结构示意图为 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。
⑵ CCl4分子中C原子采取 杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号)
a.2个σ键 b.2个π键 c.1个σ键、1个π键
⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。
(10分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如 :
:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
(2)CCl4分子中C原子采取 杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是  (填序号):
(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ?mol-1、NaCl-786kJ?mol-1。导致两者晶格能差异的主要原因是 。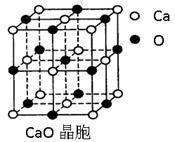
(14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴写出铬的原子结构示意图为 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。
⑵ CCl4分子中C原子采取 杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号)
a.2个σ键 b.2个π键 c.1个σ键、1个π键
⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ?mol-1、NaCl-786kJ?mol-1。导致两者晶格能差异的主要原因是 。
(10分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
(2)CCl4分子中C原子采取 杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com