
题目列表(包括答案和解析)
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
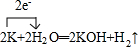
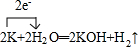
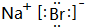
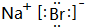
 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o |

族 周期 |
ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | 0族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |


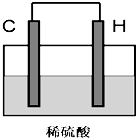
| 元素 | 实验设计 | 现象 | 结论 |
| B | 金属性:B > > F(填“>”、“<”或“=”) | ||
| F |
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com