
题目列表(包括答案和解析)
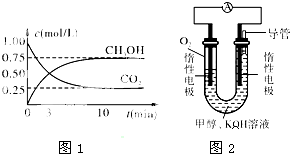
 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| 加热 |
| 加热 |
2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
(1)下列方程中H2O2所体现的性质与其可以作为消毒剂完全一致的是??????? 。
A.BaO2+2HCl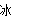 H2O2+BaCl2
H2O2+BaCl2
B.Ag2O+H2O2 =2Ag+O2+H2O???
C.2H2O2 2H2O+O2↑
2H2O+O2↑
D.H2O2+NaCrO2+NaOH=Na2CrO4 +H2O
(2)火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g)? △H= - 534 kJ·mol-1???
H2O2(1)=H2O(1)+1/2O2(g)? △H= - 98.64 kJ·mol-1
H2O(1)=H2O(g)? △H=+44kJ·mol-l
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H=?????????? ,
该反应的△S=??????? 0(填“>”或“<”)。
(3)H2O2是一种不稳定易分解的物质。
①如图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图

②实验证实,往Na2CO3溶液中加入H2O2也会有气泡产生。已知常温时H2CO3的电离常数分别为Kal=4.3×l0-7,Ka2 = 5.0 ×l0-11 。Na2CO3溶液中CO32-第一步水解常数表达式Khl=????? ,常温时Khl的值为??????????? 。若在Na2CO3溶液中同时加入少量Na2CO3固体与适当升高溶液温度,则Khl的值
?????????? (填变大、变小、不变或不确定)。
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。

注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L-l的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是????????????????? (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低??????
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢?????
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
(1)下列方程中H2O2所体现的性质与其可以作为消毒剂完全一致的是 。
A.BaO2+2HCl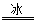 H2O2+BaCl2
H2O2+BaCl2
B.Ag2O+H2O2 =2Ag+O2+H2O
C.2H2O2 2H2O+O2↑
2H2O+O2↑
D.H2O2+NaCrO2+NaOH=Na2CrO4 +H2O
(2)火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H=" -" 534 kJ·mol-1
H2O2(1)=H2O(1)+1/2O2(g) △H=" -" 98.64 kJ·mol-1
H2O(1)=H2O(g) △H=+44kJ·mol-l
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
该反应的△S= 0(填“>”或“<”)。
(3)H2O2是一种不稳定易分解的物质。
①如图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图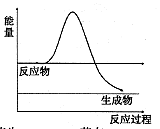
②实验证实,往Na2CO3溶液中加入H2O2也会有气泡产生。已知常温时H2CO3的电离常数分别为Kal=4.3×l0-7,Ka2 =" 5.0" ×l0-11 。Na2CO3溶液中CO32-第一步水解常数表达式Khl= ,常温时Khl的值为 。若在Na2CO3溶液中同时加入少量Na2CO3固体与适当升高溶液温度,则Khl的值
(填变大、变小、不变或不确定)。
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。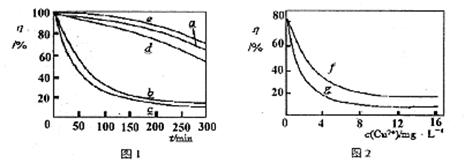
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L-l的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是 (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
 H2O2+BaCl2
H2O2+BaCl2 2H2O+O2↑
2H2O+O2↑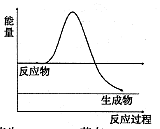

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com