
题目列表(包括答案和解析)
 SiHCl3+H2。
SiHCl3+H2。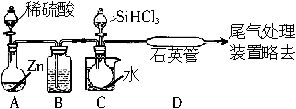
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl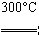 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100°C反应制得纯硅。
已知SiHCl3能与H2O剧烈反应,在空气中易自燃。
请回答下列问题:
(1)第①制备粗硅的化学方程式为__________________________ ____________________________________________________________________________________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0°C)中含有少量SiCl4(沸点57.6°C)和HCl(沸点84.7°C),提纯SiHCl3的方法为__________________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
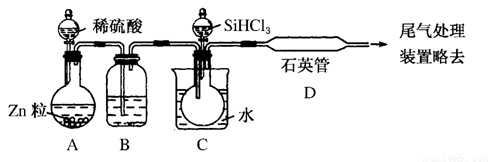
①装置B中的试剂是________,装置C中的烧瓶需要加热,其目的是__________________。
②装置D中发生反应的化学方程式为__________________________________________________________________________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________。
(18分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如 下:
下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
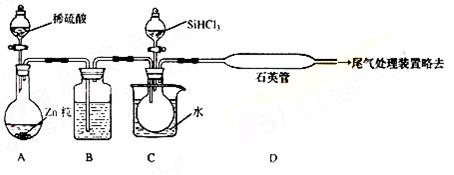
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
 SiHCl3+H2;
SiHCl3+H2; 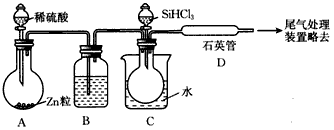
 SiCl3+H2
SiCl3+H2 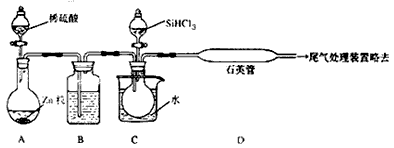
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com