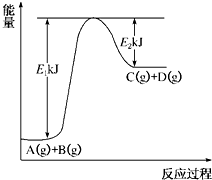
已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
(1)该反应的△H=
kJ?mol
-1(用含E
1、E
2的代数式表示).
(2)若在反应体系中加入催化剂使逆反应速率增大,则E
1
(填“增大”、“减小”或“不变”,下同),△H
.
(3)在相同温度和压强下,对反应A(g)+B(g)?C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
|
A |
B |
C |
D |
| 甲 |
a mol |
a mol |
0 |
0 |
| 乙 |
2a mol |
a mol |
0 |
0 |
| 丙 |
a mol |
a mol |
a mol |
a mol |
| 丁 |
a mol |
0 |
a mol |
a mol |
上述四种情况达到平衡后,C(D)的大小顺序是
.
A.甲=丙>乙=丁 B.乙>丁>甲>丙 C.丁>乙>甲=丙 D.丙>乙=丁>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):
.
(5)在恒温恒容条件下进行上述反应.下列情况可以判断该反应达到平衡状态的是
A.气体平均摩尔质量不再变化 B.气体压强不再变化
C.气体密度不再变化 D.消耗A的速率等于消耗D的速率
E.各组分浓度之比为1:1:1:1 F.C生成的速率等于B消耗的速率.

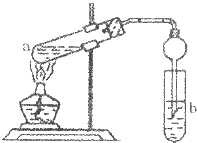 “酒是陈年的香”是因为酒在储存中会生成有香味的乙酸乙酯.在实验室我们可以用如图所示装置来制取乙酸乙酯:在试管a中先加入3mL的无水乙醇和2mL浓硫酸混合液,冷却后再加入2mL冰醋酸,混合均匀后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.装置连接好后,用酒精灯对试管a加热,当试管b中收集到较多的乙酸乙酯时停止实验.请回答下列问题:
“酒是陈年的香”是因为酒在储存中会生成有香味的乙酸乙酯.在实验室我们可以用如图所示装置来制取乙酸乙酯:在试管a中先加入3mL的无水乙醇和2mL浓硫酸混合液,冷却后再加入2mL冰醋酸,混合均匀后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.装置连接好后,用酒精灯对试管a加热,当试管b中收集到较多的乙酸乙酯时停止实验.请回答下列问题: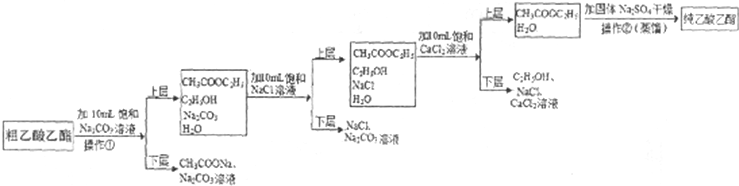
 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷: 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题: