
题目列表(包括答案和解析)
(10分)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A的离子结构示意图是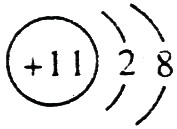 ,C的原子结构示意图是
,C的原子结构示意图是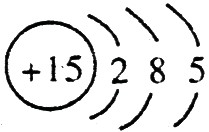 。
。
(2)C的最高价氧化物对应的水化物与A的氢氧化物生成三种盐,化学式分别为Na3PO4、Na2HPO4、NaH2PO4。
(3)C、D的气态氢化物稳定性由强到弱的顺序是 HCl>PH3。
【解析】 最高正价=原子最外层电子数,B元素的原子最外层电子数应为4,B元素原子的次外层电子数为2,为K层,B元素原子核外共有2+4=6个电子,B是6号元素碳;A、C原子次外层电子数为8,则A、C原子核外电子数分别是:2+8+1=11和2+8+5=15,所以A为11号元素钠,C为15号元素磷;在1~18号元素中,最高价为+7的只有氯元素(F无正价),而HClO4是已知含氧酸中最强的酸,故D为氯。
(1)钠总是+1价,其离子结构示意图为: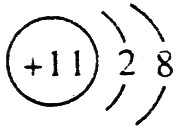 ;磷的原子序数是15,其原子结构示意图是:
;磷的原子序数是15,其原子结构示意图是: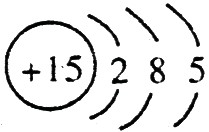 。
。
(2)磷的最高价(+5)氧化物对应的水化物是H3PO4,与NaOH反应生成:Na3PO4、NaH2PO4三种盐。
(3)P、Cl原子都具有3个电子层,核电荷数P(15)小于Cl(17),原子半径r(P)>r(Cl),所以非金属Cl>P,气态氢化物稳定性HCl>PH3。
(1)常温下将气体B通入水中发生反应,生成A和D,则D的化学式为_________________。
(2)E分子的空间构型是_______________________;写出E与氧气反应生成A的化学方程式_______________________________________________。
(3)写出工业合成E反应的化学方程式______________________________________________。
若使该平衡向生成E的方向移动,可采取的措施有(填字母序号)__________________。
A.升高温度 B.增大压强
C.使用催化剂 D.液化分离E
(4)D和E生成的化合物在某温度下加热分解,同时生成两种氧化物。且在此过程中,若有0.5 mol该化合物完全反应,转移电子数为2 mol。写出该反应的化学方程式__________________
_____________________________________________________________________。
(11分)A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为________________乙与甲的水溶液反应的离子方程式为_______________________________________.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为 ______________________
(3)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_____________,1 mol戊与过量盐酸反应的离子方程式是 ________________________ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是_______________________________________________________________;8 g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式
________________________________________________________________
(11分)A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为________________乙与甲的水溶液反应的离子方程式为_______________________________________.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为 ______________________
(3)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_____________,1 mol戊与过量盐酸反应的离子方程式是 ________________________ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是_______________________________________________________________;8 g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式
________________________________________________________________
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4︰1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2︰1的离子化合物丙。
⑴ D的原子结构示意图为 ,B单质的电子式为 ,E在周期表中的位置为 ;
⑵ 下列说法正确的有 ;
a.化合物乙为正四面体形分子,是由极性键构成的非极性分子
b.C、D、E、F原子半径由大到小的顺序为 C > D > E > F
c.B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
d.化合物甲和化合物丙都含有离子键和共价键
⑶ 将F在空气中完全燃烧的产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应:
;
⑷ 写出一个由以上元素构成的10 e- 微粒与18 e- 微粒反应的离子方程式:
;
⑸ 在1 mol·L-1 甲溶液中,下列关系式正确的是 ;[来源:学§科§网]
a.c(NO3-) > c(NH4+) > c(H+) > c(OH-)
b.c(NH4+) > c(NO3-) > c(H+) > c(OH-)
c.c(NO3-) = c(NH4+) > c(H+) = c(OH-)
d.c(NH4+) = c(NO3-) > c(H+) > c(OH-)
⑹ 25 ℃时,丙的水溶液的pH大于7,其原因是(用离子方程式解释):
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com