
题目列表(包括答案和解析)
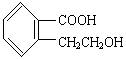 它可通过不同的化学反应分别制得下列物质:
它可通过不同的化学反应分别制得下列物质:
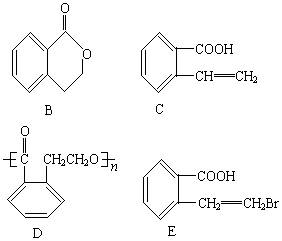
制取B、C、D、E四种物质对应的有机反应类型分别为B:________C:________D:________E:________。
(2)不久前,欧盟对我国出口的酱油进行检测发现,部分酱油中3-氮-1,2-丙二醇(CH2Cl-CHOH-CH2OH)含量最高达10mg/L,超过欧盟规定的该项指标的一千倍。①3-氯-1,2-丙二醇和1,3-二氯-2-二氯-2-丙醇统称为“氯丙醇”,都是致癌物。1,3-二氯-2-丙醇的结构简式是( )
A.CH2OH—CHCl—CH2OH
B.CH2CL—CHOH—CH2Cl
C.CH2OH—CHOH—CH2Cl
D.CH2Cl—CHOH—CH(OH)Cl
②我国就此作了调查并对酱油进行技术处理,使酱油中不含氯丙醇或不超标。技术处理过程中应用的反应是( )
A.加成反应
B.氧化反应
C.消去反应
D.取代反应
(3)A是日常生活中常见的一种有机物,A在一定条件下有如下的转化关系:

B是无氧化合物,且是其同系物中相对分子质量最小的物质,B能使紫色石蕊试液变红,则A的结构简式为________,A、B、C、D四种物质中易溶于水的物质是________(填写序号)。
(4)化学式为C4H6O5的有机物A有如下性质:
Ⅰ.1 mol A+2 mol NaOH→正盐
![]()
![]()
Ⅳ.A的分子内脱水产物(不是环状化合物)可使溴水褪色试回答:
①根据以上信息,对A的结构的正确判断是(选填序号)________。
a.肯定有碳碳双键 b.有两个羧基
c.肯定有醇烃基 d.有RCOOR′结构
②若A分子中不含甲基,其结构简式为________或________。
③写出A分子内脱水产物与溴水反应的化学方程式(只写一个)
________________________________
④写出A的一个同类别的同分异构体(含甲基)的结构简式
________________________________
(1)有机物A的结构简式为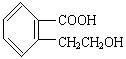 它可通过不同的化学反应分别制得下列物质:
它可通过不同的化学反应分别制得下列物质:
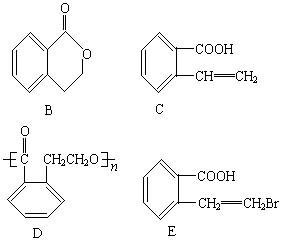
制取B、C、D、E四种物质对应的有机反应类型分别为B:________C:________D:________E:________。
(2)不久前,欧盟对我国出口的酱油进行检测发现,部分酱油中3-氮-1,2-丙二醇(CH2Cl-CHOH-CH2OH)含量最高达10mg/L,超过欧盟规定的该项指标的一千倍。①3-氯-1,2-丙二醇和1,3-二氯-2-二氯-2-丙醇统称为“氯丙醇”,都是致癌物。1,3-二氯-2-丙醇的结构简式是( )
A.CH2OH—CHCl—CH2OH
B.CH2CL—CHOH—CH2Cl
C.CH2OH—CHOH—CH2Cl
D.CH2Cl—CHOH—CH(OH)Cl
②我国就此作了调查并对酱油进行技术处理,使酱油中不含氯丙醇或不超标。技术处理过程中应用的反应是( )
A.加成反应
B.氧化反应
C.消去反应
D.取代反应
(3)A是日常生活中常见的一种有机物,A在一定条件下有如下的转化关系:

B是无氧化合物,且是其同系物中相对分子质量最小的物质,B能使紫色石蕊试液变红,则A的结构简式为________,A、B、C、D四种物质中易溶于水的物质是________(填写序号)。
(4)化学式为C4H6O5的有机物A有如下性质:
Ⅰ.1 mol A+2 mol NaOH→正盐
![]()
![]()
Ⅳ.A的分子内脱水产物(不是环状化合物)可使溴水褪色试回答:
①根据以上信息,对A的结构的正确判断是(选填序号)________。
a.肯定有碳碳双键 b.有两个羧基
c.肯定有醇烃基 d.有RCOOR′结构
②若A分子中不含甲基,其结构简式为________或________。
③写出A分子内脱水产物与溴水反应的化学方程式(只写一个)
________________________________
④写出A的一个同类别的同分异构体(含甲基)的结构简式
________________________________
(1)下图是一种用于显示事物异同点的信息处理方法。例如A图中的两个圆分别代表铝和铁的有关信息,两圆重叠的区域表示铝和铁的共同点(相似点),重叠区域以外的部分表示它们独有的特征(不同点)。请你在下面横线上用化学方程式来表示与图中①②区域对应的化学性质上的不同之处(每处只要求写一个)。
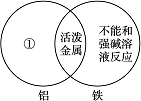 A
A
 B
B
①________________________________________________________________________;
②________________________________________________________________________;
(2)为了测定铁铝合金中金属的质量分数,某校研究性学习小组设计了如下实验操作过程:称取该合金1.0g,放入烧杯中加足量盐酸,盖上表面皿,使其充分反应;反应停止,经冷却向其中加入过量NaOH溶液,充分静置后过滤,对滤出的沉淀经洗涤在空气中加热灼烧至恒重,得到固体物质1.2g。下列有关叙述不正确的是________。
A.铁的质量为0.84g
B.Al的质量分数为16%
C.加入过量NaOH溶液的目的是为了Fe2+完全沉淀
D.加入NaOH溶液后充分静置是为了保证Fe(OH)2被空气中的氧气充分氧化为Fe(OH)3
(3)Al(OH)3和NaHCO3都是治疗胃酸过多的药物,用离子方程式表示其原理,________________,______________。根据上述反应,如果是胃酸过多且有胃溃疡的患者,应该选用上述哪一种药物治疗为好________,理由是________________________。
在火烧圆明园时流失了大量的国宝,如:铜铸的鼠首和兔首。普通铜器时间稍久容易出现铜绿,其主要成分是〔Cu2(OH)2CO3〕,这两件1760年铜铸的国宝在240多年后看上去仍然熠熠生辉不生锈,下列对其原因的分析最可能的是
A.它们的表面都电镀上了一层耐腐蚀的黄金
B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C.铜的金属活动性比氢小,因此不易被氧化
D.它是含一定比例金、银、锡、锌的铜合金
不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只有1个选项,多选时,该题为0分;若有2个正确选项,只选1个且正确得2分;选2个且都正确给4分;但只要错选1个,该小题0分)
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象;
乙:① 用pH计测定物质的量浓度均为0.1mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/25 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
E.稀释后A溶液中水的电离程度比B溶液中水的电离程度小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com