
题目列表(包括答案和解析)

削过皮的苹果过一段时间后颜色就会由白色变为褐色,食品科学上称为“褐变”.某研究性学习小组查阅有关资料,发现不同文献解释不同.
Ⅰ、《化学教学》:苹果中Fe2+被空气中的O2氧化成Fe3+而变色.
Ⅱ、《中学化学教学参考》:苹果中的酚类物质在苹果中的氧化酶催化下被空气中的O2氧化而生成有色物质.
已知酚类物质遇FeCl3溶液常发生颜色反应而呈现一定颜色.如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
(1)为探究苹果“褐变”是否为I的原因,小组设计了如下实验:①刚削皮的苹果立刻滴上2~3滴A溶液,继而再滴上几滴氯水.②在“褐变”后的苹果滴上2~3滴A溶液.
回答下列问题:
A溶液是________溶液(填化学式).若I的解释正确,写出①中有关的离子方程式:________________________________;
实验①②的实验现象应为:①________________________.
②________________________.
经实验,①②均无明显现象.说明观点I的解释是错误的.
(2)为探究苹果“褐变”是否为II的原因,小组又设计了如下实验.在表中填写实验①②探究目的和结论.


(A)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mL FeSO4溶液 | 10 mL NH3 | 生成白色沉淀,后变色 |
2 | 20 mL H2S | 10 mL SO2 |
|
3 | 30 mL NO2(主要) | 10 mL H2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mL Cl2 | 40 mL NH3 |
|
试回答下列问题:
(1)实验1中,沉淀最终变为___________色,写出沉淀变色的化学方程式_______________。
(2)实验2甲针筒内的现象是:有________生成,活塞___________移动(填“向外”“向内”或“不”)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入__________溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是__________,写出NO2与H2O反应的化学方程式_______________________________。
(4)实验4中,已知:3Cl2+2NH3![]() N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
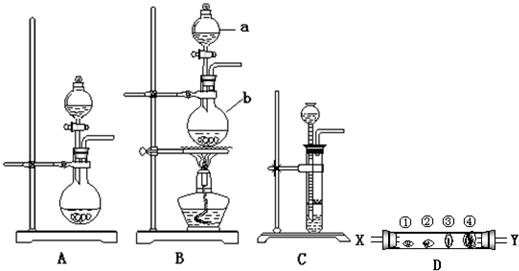
(B)某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式
_____________________________________________________________________
_____________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是____________________;乙的作用是_____________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是____________________________。集气瓶中收集到的气体的主要成分是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入______________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过_____________(填实验操作名称)即可除去。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com