
题目列表(包括答案和解析)
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)

(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键 (填“离子”或 “极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键(填“离子”或“极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红 褐色
褐色
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象

(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。

浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
|
甲杯硫酸铜浓度 mol/L |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
|
乙杯硫酸铜浓度 mol/L |
0.8 |
0.4 |
0.2 |
0.1 |
0.05 |
0.025 |
|
两杯溶液浓度差值 |
0 |
0.4 |
0.6 |
0.7 |
0.75 |
0.775 |
|
电压 mV |
0 |
6 |
12 |
16 |
22 |
26 |
|
电流 mA |
0 |
0.02 |
0.04 |
0.06 |
0.07 |
0.08 |
实验B:温差电池:表2
|
甲杯硫酸铜温度℃ |
19 |
19 |
19 |
19 |
19 |
19 |
|
乙杯硫酸铜温度℃ |
19 |
29 |
39 |
49 |
59 |
69 |
|
两杯溶液温差℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
电压 mV |
0 |
6.1 |
12 |
20[来源:] |
27 |
34 |
|
电流 mA |
0 |
0.025 |
0.047 |
0.07 |
0.15 |
0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
(本题共12分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;54 g D的单质跟足量盐酸反应,生成D3+和67.2 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。

①B、D的最高价氧化物对应水化物相互反应的离子方程式为: 。
②用电子式表示C与E形成E2C的过程: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为 。
②在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,反应离子方程式是__________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
(12分)利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
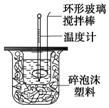
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高
温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为
57.3 kJ/mol):_______________________________________________。
(2)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
|
2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
|
4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com