
题目列表(包括答案和解析)
下列除杂顺序正确的是( )
A.①②③④⑤⑥ B.②③④①⑤⑥ C.③①②④⑤⑥ D.①③④②⑤⑥
①加入过量的Na2CO3溶液
②加入过量的NaOH溶液
③加入过量的BaCl2溶液
④过滤除去沉淀
⑤在溶液中加盐酸调节pH
⑥通过阳离子交换塔得精制盐水
下列除杂顺序正确的是( )
A.①②③④⑤⑥ B.②③④①⑤⑥
C.②④⑤⑥③① D.①③④②⑤⑥
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐。
请回答下列问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器。
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为_______________________。
(3)步骤2中,判断加入BaCl2已过量的方法是_______________________。
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是_______
______________________________________________________。
(5)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的两处错误是:

____________________________________________________________________,
____________________________________________________________________。
若在定容时仰视,则所配溶液的浓度__________0.2 mol·L-1(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是________________________。
(13分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
_______________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
________________________________________________________________________.
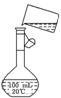 (5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转移溶液的示意图,图中的两处错误是:
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是:________________________________________________________________________.
(13分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备 精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
_______________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
________________________________________________________________________.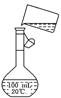 (5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转移溶液的示意图,图中的两处错误是:[来源:学|科|网]
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是: ________________________________________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com