
题目列表(包括答案和解析)
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为 。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42- 浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=—97.3kJ/mol
SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l)
△H=—97.3kJ/mol
SO2Cl2(l)
△H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为 。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42- 浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
(分)苯甲酸甲酯:
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g·cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(![]() )是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化。
)是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化。
有关物质的物理性质见右表。
Ⅰ苯甲酸甲酯的合成和提纯。
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应;第二步:水洗提纯;第三步:蒸馏提纯。
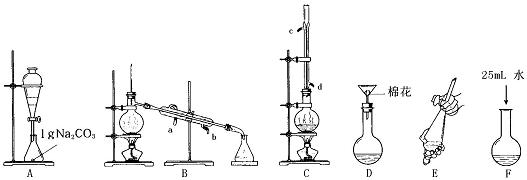
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有15.0g苯甲酸和20.0mL过量的甲醇外,还需要加入___________、______________ 。
(3)步聚F向酯化完成后,卸下的烧瓶中加入25mL水的作用是_____ ___ _ __;A装置中固体Na2CO3作用是_______ __。
(4)步骤E的操作要领是 。
(5)装置A的分液漏斗中液体分为两层,苯甲酸甲酯应在 (填上、下)层;B装置蒸馏时,接收苯甲酸甲酯前(温度<199.6℃)锥形瓶中得到的物质是 。
(Ⅱ)苯甲酸甲酯的皂化反应
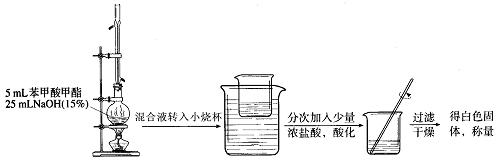
① ② ③
(6)装置①中冷凝管的作用是: ;
能说明①装置中反应完全的现象是_____________。
(7) 在③中得到白色固体的质量为5.9g。假设反应(Ⅰ)和反应(Ⅱ)中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,其它步骤的转化效率为100%,请计算酯化反应中苯甲酸的转化率,写出简要计算过程:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com