
题目列表(包括答案和解析)
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子 的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2
(g)+3B2 (g)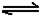 2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2 (g)+3B2 (g)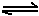 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。右图是一种航天器能量储存系统原理示意图。 下列说法正确的是

A.装置X每消耗1 mol H2O,就可为燃料电池提供22.4 L燃料
B.该系统中最多存在3种形式的能量转化
C.装置Y中正极的电极反应式为:
O2+2H2O+4e-→4OH-
D.装置X、Y形成的子系统实现了物质的零排放,并能实现化学能与电能间的完全转化
右图是一种航天器能量储存系统原理示意图。 下列说法正确的是
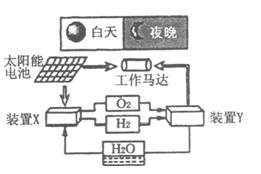
A.装置X每消耗1 mol H2O,就可为燃料电池提供22.4 L燃料
B.该系统中最多存在3种形式的能量转化
C.装置Y中正极的电极反应式为:
O2+2H2O+4e-→4OH-
D.装置X、Y形成的子系统实现了物质的零排放,并能实现化学能与电能间的完全转化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com