
题目列表(包括答案和解析)
 MnSO4+2NH3↑+CO2↑+H2O。
MnSO4+2NH3↑+CO2↑+H2O。 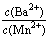 =__________。 [已知Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11]
=__________。 [已知Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11] 
 MnSO4+2NH3↑+CO2↑+H2O。
MnSO4+2NH3↑+CO2↑+H2O。 =__________。
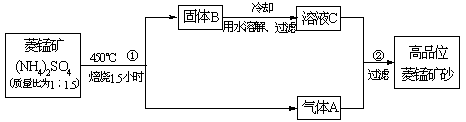
=__________。已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示:

已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。
(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是________(填离子符号);当两种沉淀共存时,溶液中![]() =________。
=________。
[Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11]
(7分) 已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(贫矿)转化为高品位“菱锰矿砂”的绿色工艺。该工艺首先将矿砂与硫酸铵一起焙烧,较佳条件是:投料比m[(NH4)2SO4]/m[MnCO3]=1.5;焙烧温度450oC;焙烧时间1.5 小时。
4-1 写出焙烧反应方程式:
4-2 其次,将焙烧产物转化为高品位的“菱锰矿砂”,写出反应方程式:
4-3 若焙烧温度过高或时间过长,将导致什么结果?
4-4 从物料平衡角度看,生产过程中是否需要添加(NH4)2SO4?说明理由。
已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石.有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺.该工艺流程如下图所示:
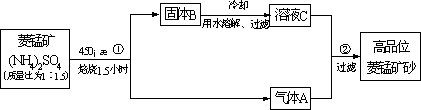
已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3![]() MnSO4+2NH3↑+CO2↑+H2O.
MnSO4+2NH3↑+CO2↑+H2O.
(1)写出反应②的离子方程式________.
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、________、________.从物料平衡角度看,理论上生产过程中________(填“需要”或者“不需要”)添加(NH4)2SO4.
(3)向物质的量浓度均为0.01 mol·L-1的MnSO4和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是________(填离子符号);当两种沉淀共存时,溶液中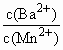 =________.
=________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com