
题目列表(包括答案和解析)
为了测定氢氧化钠和碳酸钠固体混合物中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(I)甲同学的方案是:将mg样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ,甲同学洗涤沉淀的具体操作是 。
(2)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:① ;
② 。
(Ⅱ)乙同学的方案如图所示: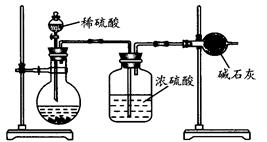
(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行 次称量操作。按照该同学的方案进行测定,结果与实际情况存在较大的误差,你认为主要原因可能是(任写两个):
① ;
② 。
(2)乙同学的方案的装置中存在一定的缺陷,请你提出改进的方法(简单叙述做法,不必画图): 。
为了测定氢氧化钠和碳酸钠固体混合物m g中碳酸钠的质量分数,甲、乙、丙三位同学分别设计了如下的实验方案:
(1)甲同学的方案是:将样品溶解,加过量氯化钡溶液,过滤洗涤,取沉淀烘干,称量得固体n g.则混合物中碳酸钠的质量分数为________;若Ca2+、Ba2+都可使![]() 沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是________.
沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是________.
(2)乙同学的方案是:将样品溶解后,加入稍过量的氯化钡溶液,再滴入2~3滴________试液做指示剂,用标准盐酸滴定.乙同学在滴定过程中所需要的主要玻璃仪器有________、________.加入过量氯化钡溶液的目的是________.
(3)丙同学的方案如图所示:
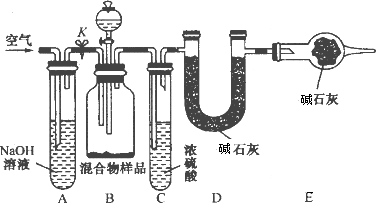
当混合物样品充分反应完全时,缓慢通入空气的目的是________,其中,装置A的作用是________.
(1)甲同学的方案是:将样品溶解,加入过量氯化钡溶液,过滤,将沉淀洗涤、烘干,称量所得固体质量为n g。
①检验沉淀已经洗净的方法为____________________________________________。
②此混合物中碳酸钠质量分数的计算式为_________________________________________。
(2)乙同学的方案是:将样品溶解,加入过量氯化钡溶液,再滴入2—3滴酚酞试液,用a mol/L标准盐酸滴定,到达滴定终点时消耗盐酸b mL。
①乙同学在滴定过程中所需要的主要玻璃仪器有______________、______________。
②此混合物中碳酸钠质量分数的计算式为______________。
(3)丙同学的方案如下图所示:
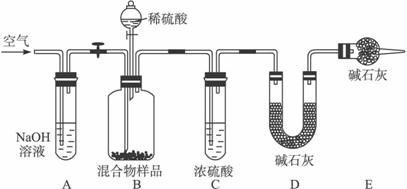
①装置C的作用是____________________________________________________。
②当混合物样品充分反应后,缓慢通入空气的目的是:_____________________________。
为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案:
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施 ;
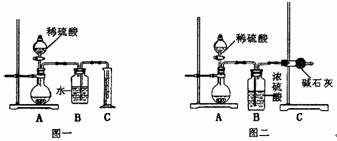
(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①
②
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品m g,放入锥形瓶中加蒸馏水溶解,加1―2滴酚酞指示剂,用物质的量浓度为c mol?L―1的HCl溶液滴定至溶液由红色至无色(指示CO32―+H+=HCO3―反应的终点),消耗HCl溶液体积为V1mL,再加入1―2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++HCO3―=CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2ml。则烧碱样品中Na2CO3的质量分数为 ;
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤
②用测得的数据(用字母表示)写出质量分数的表达式 。
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施_______________________。

(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①__________________________________________________________________,
②__________________________________________________________________。
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品mg,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色至无色(指示![]() +H+
+H+![]()
![]() 反应的终点),消耗HCl溶液体积为V1mL,再加入1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++
反应的终点),消耗HCl溶液体积为V1mL,再加入1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++![]()
![]() CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2mL。则烧碱样品中Na2CO3的质量分数为_____________________。
CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2mL。则烧碱样品中Na2CO3的质量分数为_____________________。
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤。
②用测得的数据(用字母表示)写出质量分数的表达式_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com