
题目列表(包括答案和解析)

(1)将气体b中的Cu粉小心倒入烧瓶中,要使Cu粉发生反应,是否一定需要对反应混合物进行加热(填“是”或“否”) ,发生反应的化学方程式是 ;充分反应后Cu粉有剩余,在反应过程中可观察到的现象是:① ,② ,③ ,④ ;
(2)欲加快铜与硝酸的反应速率,可采用多种不同的措施,若采用化学试剂法,下列试剂中可以使用的是(填代号) ;
A.蒸馏水 B.无水醋酸钠 C.石墨 D.AgNO3(少量)
(3)将烧瓶不断振荡,发现气球逐渐变小,直至被吸入烧瓶内,发生这一现象的原因是(用化学方程式表示) 。
(4)打开弹簧夹将CO2推入干燥管内继续振荡,使气体与气体、气体与液体间充分接触,可使剩余铜粉完全溶解,上述整个过程用一个总化学方程式表示则为:
,在此过程中,至少需要CO2 mL。(标准状况)
如图装置中,a是250
mL的烧瓶,其中盛有标准状况下的空气(O2占![]() )和1.2 mol•L-1硝酸10
mL;b是未充气且放有0.384 g Cu粉的气球;C是夹紧的弹簧夹;d是盛有足量Na2O2的干燥管;e是充有CO2的注射器,整套装置不漏气。
)和1.2 mol•L-1硝酸10
mL;b是未充气且放有0.384 g Cu粉的气球;C是夹紧的弹簧夹;d是盛有足量Na2O2的干燥管;e是充有CO2的注射器,整套装置不漏气。

(1)将气体b中的Cu粉小心倒入烧瓶中,要使Cu粉发生反应,是否一定需要对反应混合物进行加热(填“是”或“否”) ,发生反应的化学方程式是 ;充分反应后Cu粉有剩余,在反应过程中可观察到的现象是:① ,② ,③ ,④ ;
(2)欲加快铜与硝酸的反应速率,可采用多种不同的措施,若采用化学试剂法,下列试剂中可以使用的是(填代号) ;
A.蒸馏水 B.无水醋酸钠 C.石墨 D.AgNO3(少量)
(3)将烧瓶不断振荡,发现气球逐渐变小,直至被吸入烧瓶内,发生这一现象的原因是(用化学方程式表示) 。
(4)打开弹簧夹将CO2推入干燥管内继续振荡,使气体与气体、气体与液体间充分接触,可使剩余铜粉完全溶解,上述整个过程用一个总化学方程式表示则为:
,在此过程中,至少需要CO2
mL。(标准状况)
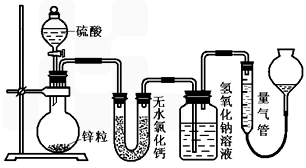
(10分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10l kPa,温度为0℃)。
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
A.200 mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重l.28 g ,则圆底烧瓶中发生反应的化学方程式为:_______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,则有方程:a g/65g·mol-1=b g/64g·mol-1+V mL / 22400 mL·mol-1,其依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,再加入V L c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的比值将 (填
偏大、偏小或无影响)
(15分) 某同学设计了如下图所示装置(部分夹持装置已略去),该装置可以用来进行多项
实验研究。
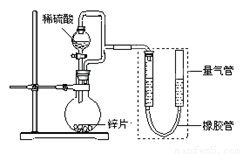
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
|
序号 |
V(H2SO4)/mL |
c(H2SO4)/mol·L-1 |
t/s |
|
Ⅰ |
40 |
1 |
t1 |
|
Ⅱ |
40 |
4 |
t2 |
比较实验Ⅰ和Ⅱ可以得出的实验结论是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度。
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为 。
②本实验在读数前对量气管的操作是 。
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将 。(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com