
(2011?海淀区二模)某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
提供的试剂:研细的钙片粉末(钙片中的其他成分不与盐酸反应)、2mol/L 盐酸、5%NaOH溶液、饱和Na
2CO
3溶液、饱和NaHCO
3溶液和蒸馏水.
实验过程:
Ⅰ.检查两套装置的气密性.
Ⅱ.在A、C的右边加入0.25g钙片粉末,左边加入3mL 2mol/L盐酸,塞紧塞子.在B、E中均加入饱和NaHCO
3溶液,如图所示,记下量气管读数.
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得 B中收集到的气体为41.90mL,E中收集到的气体体积为39.20mL(以上气体体积均已折算为标准状况下的体积).
回答下列问题:
(1)Ⅰ中检查图1装置气密性的方法是
往B中右侧量气管中加水,一段时间后量气装置左右液面差不变,说明气密性良好
往B中右侧量气管中加水,一段时间后量气装置左右液面差不变,说明气密性良好
.
(2)A中发生反应的离子方程式为
CaCO3+2H+═Ca2++CO2↑+H2O
CaCO3+2H+═Ca2++CO2↑+H2O
;D中加入的试剂为
蒸馏水
蒸馏水
.
(3)实验前左右两管液面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是
向下移动右管,使左右两管液面相平
向下移动右管,使左右两管液面相平
.
(4)图2实验所得钙片中的碳酸钙的质量分数为
70%
70%
;图1实验比图2实验所得钙片中的碳酸钙含量偏高,用离子方程式表示偏高的原因:
HCO3-+H+═CO2↑+H2O
HCO3-+H+═CO2↑+H2O
.

 (2011?海淀区二模)某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
(2011?海淀区二模)某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去. 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去. 已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.
已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.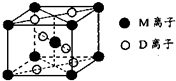 (2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.
(2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.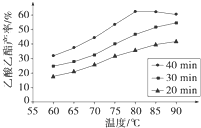 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)