
题目列表(包括答案和解析)
如下图所示,在烧杯A、B中盛有20℃的水50 mL,试管C、D上端用玻璃管和橡皮管相通,试管内充满红棕色气体,它处于平衡状态:2NO2![]() N2O4(正反应放热).然后用夹子夹住橡皮管.再向A中加入50g NH4NO3,向B中加入2g NaOH,使之溶解.
N2O4(正反应放热).然后用夹子夹住橡皮管.再向A中加入50g NH4NO3,向B中加入2g NaOH,使之溶解.
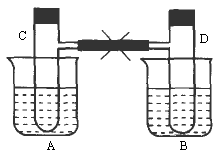
试回答下列问题:
(1)烧杯A中温度________,B中温度________.
(2)试管C中气体颜色变________,D中气体颜色变________.
(3)已知20℃时NH4NO3的溶解度为192g,则A中的溶液________达到饱和.
(4)试比较分别加NH4NO3和NaOH固体后,待气体重新达到平衡后,C、D两试管中混合气体的平均摩尔质量的关系:M(C)________M(D)(选填“大于”、“等于”或“小于”).
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。




(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。
装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。
重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2+ + MnO4—+ 8H+ ==5Fe3+ + Mn2+ + 4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 。(填字母序号)

③滴定过程中 (填“需要”或“不需要”)加入指示剂,如需要,应加入的指示剂是 。
④铁碳合金中铁元素的质量分数为 。
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。
|
|

 (1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
Ⅰ.将m,g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
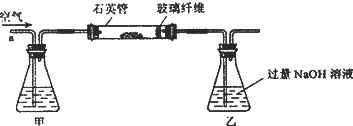
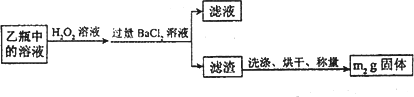
Ⅱ.反应结束后,将乙瓶中的溶液进行如图处理.
[实验二]测定铁元素的含量.Ⅲ.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250 mL;
④每次取稀释液25.00 mL,用已知物质的量浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12 g FeS2完全燃烧放热85.3 kJ,则FeS2燃烧热的化学方程式是________.
(2)Ⅰ中,甲瓶内所盛试剂是________溶液;乙瓶内发生反应的离子方程式有________;Ⅱ中玻璃纤维的作用是________.
(3)Ⅱ中,所加H2O2溶液需足量的理由是________.
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有________;
(5)该黄铁矿中硫元素的质量分数________(用Ⅰ、Ⅱ中有关实验数据表达);该黄铁矿中铁的元素的质量分数________(用Ⅰ、Ⅱ中有关实验数据表达)



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com