
题目列表(包括答案和解析)
(14分) 已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,F是混合物,黑色物质C是某金属矿物的主要成份,有磁性,E是一种非氧化性酸,H是极易溶于水的碱性气体。

请回答下列问题:
⑴写出下列物质的化学式:A 、C 、I
⑵写出反应①的化学方程式:
⑶在一定温度、压强和有催化剂存在的条件下将1 mol G和2.5 mol D放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,则用G表示20min内的平均反应速率为: ,该温度下此反应的平衡常数K= ,D的转化率为 。如果保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,D的转化率将 (填“升高”、“不变”或“降低”),再次平衡后H的体积分数为 。
(14分,每空2分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。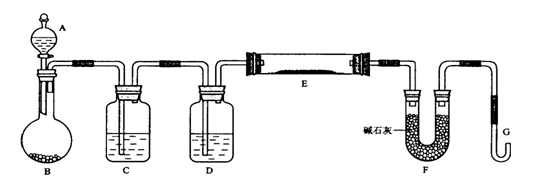
请回答下列问题。
(1)仪器中装入的试剂:C________ 、 D________;
(2)连接好装置后应首先____________________;
(3)“加热反应管E(用“H”表示)”和“从A瓶逐滴滴加液体(用“I”表示)”这两步操作应该先进行的是(用“H”或“I”表示)_____________。在这两步之间还应进行的操作是_____________________;
(4)从实验中测得了下列数据
①空E管的质量a ②E管和WO3的总质量b
③反应后E管和W粉的总质量c(充分反应后冷却到室温称量)
④反应前F管及内盛物的总质量d ⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的不含“c”字母的一个计算式(可以不写单位。除W外,其他涉及的元素的相对原子质量均为已知):
计算式:Ar(W)=____________;
(5)此实验除了要对G口余气作处理外,似还有待改正之处,否则会引起较大的误差,你认为应该作何改正?________________________ 。
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
(14分)某探究小组的同学设计实验探究铁与水蒸气的反应,并探究反应后生成物的一系列性质。

(1)右图为铁与水蒸气反应的实验装置,实验前应先进行的操作是________________
________________ __。
(2)图I为产生水蒸气的装置,图II为铁与水蒸气反应的装置,写出硬质玻璃管B内所发生反应的化学方程式______ ________________________________。
(3)为了验证硬质玻璃管B中反应后的气体产物是H2,还需从下图中选择必要的仪器和药品,设计出一套装置,其连接顺序为:a连_______,_______连_______,_______连________。(填下列装置的接口字母)

(4)反应后,将图II装置中硬质玻璃管B内的全部固体置于试管中,加入60mL1mol/L的稀盐酸,固体恰好完全溶解,再滴加KSCN溶液,发现溶液不显血红色,写出此过程中所有可能发生反应的离子方程式__________ __、_________________________、________________________。反应前硬质玻璃管B中加入Fe粉的质量为__________g.
(14分)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。

回答下列问题:
(1)起始滤液的pH_____________7(填“大于”、“小于”或“等于”)原因是________________________________________。
(2)试剂I的化学式为______________________,①中发生反应的离子方程式为_________________________________________。
(3)试剂Ⅱ的化学式为______________________,②中加入试剂Ⅱ的目的是______________________________________;
(4)试剂Ⅲ的名称是______________________,③中发生反应的离子方程式为______________________________________;
(5)某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com