
题目列表(包括答案和解析)
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4 H2(g) ![]() CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
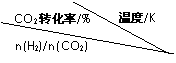 | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= ―534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
HSO4- | HSO4- | CH3COOH | HCl = H++Cl- |
10℅ | 29℅ | 1.33℅ | 100℅ |
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4 H2(g) ![]() CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
 | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= —534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
下列各选项所述的两个量,前者一定大于后者的是 ( )
①F2和Br2的沸点 ②纯水在25℃和80℃时的pH ③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4?5H2O的质量 ④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 ⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+的离子半径
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com