硝酸钾是一种重要的化工产品,工业上制备硝酸钾的流程如图所示:
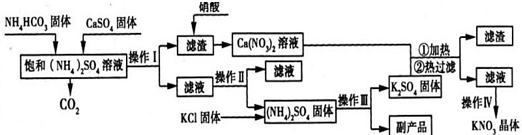
请回答下列问题:
(1)在饱和(NH
4)
2SO
4溶液中,CaSO
4与NH
4HCO
3按物质的量之比1:2恰好完全反应,该反应的化学方程式为
CaSO4+2NH4HCO3=CaCO3↓+(NH4)2SO4+H2O+CO2↑
CaSO4+2NH4HCO3=CaCO3↓+(NH4)2SO4+H2O+CO2↑
(2)操作Ⅰ是
过滤、蒸发浓缩
过滤、蒸发浓缩
,操作Ⅱ是
冷却结晶
冷却结晶
,操作Ⅲ是
过滤、加热冷却结晶
过滤、加热冷却结晶
,操作Ⅳ是
过滤
过滤
.
(3)操作Ⅲ的化学方程式是
(NH
4)
2SO
4+2KCl
K
2SO
4+2NH
3↑+2HCl↑
(NH
4)
2SO
4+2KCl
K
2SO
4+2NH
3↑+2HCl↑
,该反应中得到的副产物是
NH4Cl
NH4Cl
.
(4)Ca(NO
3)
2溶液和K
2SO
4固体反应后需要热过滤的原因是
防止KNO3冷却时结晶析出,从而导致产率下降
防止KNO3冷却时结晶析出,从而导致产率下降
.
(5)本实验中可以循环利用的物质是
硫酸钙
硫酸钙
(写名称).


