
题目列表(包括答案和解析)
A.8.9 t B.9.8 t C.6.0 t D.14.7 t
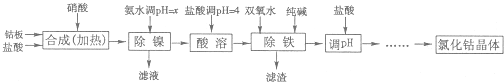
| 化学式 | 沉淀完全时的pH | 钴镍性质 | ||
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH
Ni+2HCl=NiCl2+H2↑ Co2++2H2O?Co(OH)2+2H+ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O | ||
| Fe(OH)2 | 9.6 | |||
| Fe(OH)3 | 3.7 |
| 加NH3?H2O调PH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
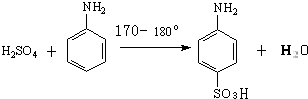
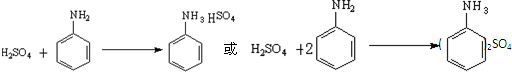
| 名称 | 性状 | 熔点/°C | 沸点/°C | 在水中的溶解度(g/100mL) |
| 苯胺 | 无色油状液体 | -6.1 | 184.4 | 3.6/18℃ |
| 对氨基苯磺酸 | 无色结晶 | 熔点365°C;内盐280~290°C | 0.8/10℃;1.08/20℃;6.67/100℃ | |


| ||
| 一定条件 |

| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
| 时间/min 浓度/mol.L |
c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
(14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2、
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3 ,则在电化学合成氨的过程中,阴极反应式为
;
2NH3 ,则在电化学合成氨的过程中,阴极反应式为
;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:

①A点时N2的浓度为 mol/L;
②右图中在状态A时,平衡常数 KA = (填写代入数值的表达式,不要求化简);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
|
时间/min 浓度/mol•L—1 |
c (N2) |
c (H2) |
c (NH3) |
|
0 |
0.6 |
1.8 |
0 |
|
3 |
0.52 |
x |
0.16 |
|
6 |
0.36 |
1.08 |
0.48 |
|
9 |
0.36 |
1.08 |
0.48 |
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.充入Ne增大压强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com