
题目列表(包括答案和解析)
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)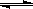 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
(6分)写出下列原子的电子排布式。
(1)S (2)29Cu (3) 26Fe
(1)________________________________________________________________________
(2)________________________________________________________________________
(3)________________________________________________________________________
(共16分,没空2分)
已知下列热化学方程式:
①C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1
②H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l) ΔH=-57.3 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
④CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
⑤HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
⑥H2(g)+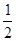 O2(g)===H2O(1) ΔH=-285.6kJ/mol
O2(g)===H2O(1) ΔH=-285.6kJ/mol
⑦C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) ΔH=-2220.0 kJ·mol-1
⑧ N2 (g)+ 3H2(g)="==" 2NH3 (g) ΔH=-92 kJ·mol-1
(1)上述热化学方程式中,不正确的有______________,不正确的理由分别是 _____________________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:______________________。
(3)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(4)已知:H2O(1)=H2O(g);ΔH=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式
(5)上述反应中,表示燃烧热的热化学方程式有__________________________________;
表示中和热的热化学方程式有______________。
(6) 已知H—H键能为436 kJ/mol,H—N键能为391kJ/mol,则N≡N键的键能是_____________?
(13分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是:
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ) 在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
(12分)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是 ;表示物质中和热的是 。
(填“ΔH1”、“ΔH2”和“ΔH3”等)
A.2H2(g)+O2(g) = 2H2O(l) ΔH1
B.C(s)+1/2O2(g) = CO(g) ΔH2
C.CH4(g)+2O2(g) = CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)= CO2(g) ΔH4
E.C6H12O6(s)+6O2(g) = 6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是 。
A.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(l) ΔH= +2akJ/mol
B.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(g) ΔH= -2akJ/mol
C.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) ΔH= -4akJ/mol
D.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(g) ΔH= -4akJ/mol
(3)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据:

已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如下图所示,则上表中a= 。

(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com