
题目列表(包括答案和解析)
(每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。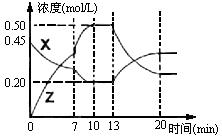
(1)0~10min 容器内气体的压强逐渐 ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
(每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。

(1)0~10min 容器内气体的压强逐渐 ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH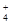 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO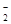 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO |
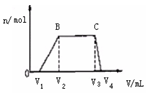
⑴ 往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1 、V2、V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
(10分) 1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO |
⑴ 往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
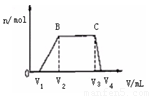
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1 、V2、 V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
|
n(Cl-) |
1.25mol |
1.5mol |
2mol |
|
n(Br-) |
1.5mol |
1.4mol |
0.9mol |
|
n(I-) |
a mol |
0 |
0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com