
题目列表(包括答案和解析)
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH ![]() 2K2CO3+6H2O
2K2CO3+6H2O
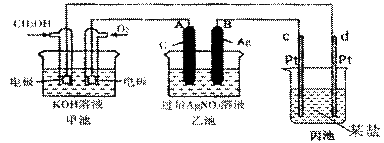
(1)图中甲池是 装置。
(2)A(石墨)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL (标准状况下);此时丙池某电极析出0.64g某金属,则丙中的某盐溶液可能是
(填序号) A. MgSO4 B.CuSO4 C.NaCL D.AgNO3
定量的CuO和0.5L稀硫酸充分反应后,再将一根50g铁棒插入上述反应后的溶液中,当铁棒质量不再增加时,铁棒增重0.24g,并收集到224mL(标准状况下)氢气。由此可推知CuO的质量
A.2.40g B.8.00g
C.6.40g D.1.92g
A.2.1g B.3.6g C.7.2g D.无法求出
(2)实验室里临时需用NaOH溶液和CO2来制取Na2CO3溶液。已知通入NaOH溶液中的CO2极易过量,从而生成NaHCO3,且无明显的现象。下表列出的是各物质在常温时的溶解度:
Na2CO3 NaHCO3 NaCl Na2SO4 NaHSO4 NaOH
15.9g 8.4g 35g 35.5g 20g 40g
①请简要叙述制得纯Na2CO3溶液的实验步骤。
②试利用表中数据求出当NaOH溶液中溶质的质量分数大于多少时,在制取Na2CO3的过程中会有晶体析出?
| A、配置100mL 1.0mol/NaOH溶液.将4.0g NaOH固体溶解再烧杯中,马上转移至100mL容量瓶,定容,摇匀 | B、探究温度对化学平衡移动的影响.烧杯中密封Cu与浓硝酸反应的气体产物,分别置于冷水和热水中,观察颜色变化 | C、探究酸性条件下淀粉的水解程度.取反应后的混合溶液于两支试管中,分别加入少量新制氢氧化铜悬浊液和碘水,观察现象 | D、出去NaCl中混有的少量NH4Cl.将盛有固体混合物的试管加热,冷却至室温 |
| 实验事实 | 结论或解释 | ① | 将40g NaOH溶于1L蒸馏水中 | 该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1molL-1 | ② | 向盛有1mL 0.1mol?L-1AgNO3溶液的试管中滴加0.1molL-1NaCl溶液,至不再有沉淀生成,再向其中滴0.1molL-1 KI溶液,白色沉淀转化为黄色沉淀. |
常温下 Ksp(AgCl)<Ksp(AgI) |
③ | 某盐NaX溶液pH>7 | 酸HX为弱酸 | ④ | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 说明溶液中一定含有Fe2+ | ⑤ | 向盛有浓硝酸的试管中分别加入Al片和 Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
还原性Al<Cu | ⑥ | BaSO4的水溶液导电性很差 | BaSO4是弱电解质 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com