
题目列表(包括答案和解析)
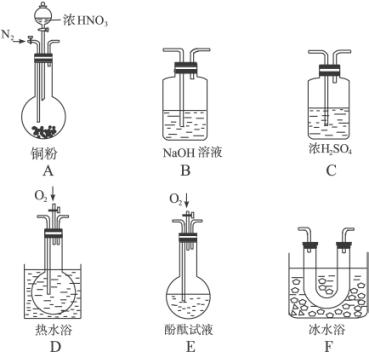
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器连接顺序表示)。
甲:A→C→F→D→B
乙:A→B→C→E
丙:A→E→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO?
甲:_________;乙:_________;丙:_________。(填“能”或“不能”)
具体说明不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答):
甲方案:___________________________________________;
乙方案:___________________________________________;
丙方案:___________________________________________。
(2)反应前先通入足量的N2,其目的是_______________________________________。
(3)确认气体中含有NO的现象是:__________________________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是:__________________________。
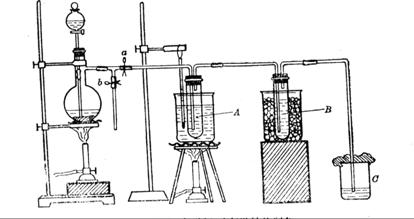
(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐,其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
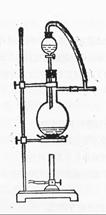
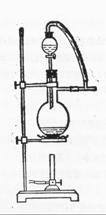
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么?可以用图二代替吗?。
图一 图二
(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐, 其物质的量之比为1:1,写出离子方程式。
其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
| A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高 | |
| B.防止生成的盐分解 | C.催化剂在冷水中活性最强 |
| D.该反应是放热反应,为防止温度过高,采用降温 |
 可以用图二代替吗?。
可以用图二代替吗?。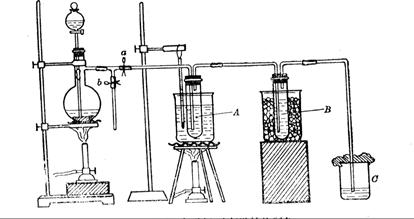
(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐,其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么?可以用图二代替吗?。

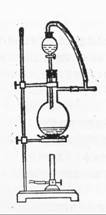
图一 图二
为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?![]()
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐,![]() 其物质的量之比为1:1,写出离子方程式。
其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么?![]() 可以用图二代替吗?。
可以用图二代替吗?。
图一 图二
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com