
题目列表(包括答案和解析)
 硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Fe(OH)2 | 开始沉淀pH | 2.7 | 4.8 | 7.6 | 完全沉淀pH | 3.7 | 6.4 | 9.6 |
(18分)
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀 硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾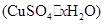 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
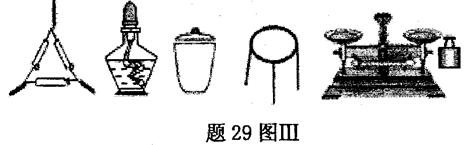
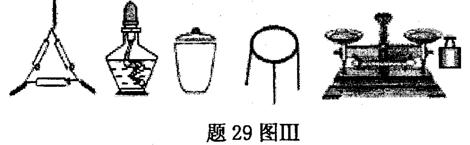
①为完成测定,题29图Ⅲ中还缺少的仪器名称是 。
②判断样品已恒重的方法是 。
③测定所得胆矾![]() 中结晶水含量的实验中,称量操作至少进行 次。
中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与 相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
(12分)硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是 。
②判断样品已恒重的方法是 。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
(18分)
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀 硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.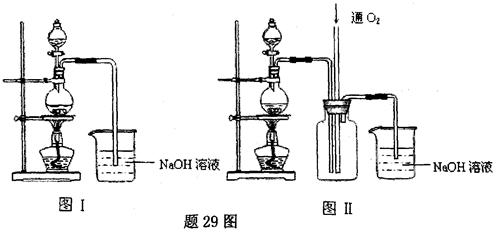
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
 中结晶水含量的实验中,称量操作至少进行 次。
中结晶水含量的实验中,称量操作至少进行 次。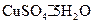 相比
相比 ) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)(18分)
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀 硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.

(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾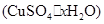 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
|
5.4g |
7.9g |
6.8g |
①为完成测定,题29图Ⅲ中还缺少的仪器名称是 。
②判断样品已恒重的方法是 。
③测定所得胆矾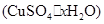 中结晶水含量的实验中,称量操作至少进行 次。
中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与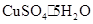 相比)
(填“偏高”、“偏低”、“不变”),可能的原因是
。(填字母序号)
相比)
(填“偏高”、“偏低”、“不变”),可能的原因是
。(填字母序号)
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com