
题目列表(包括答案和解析)
| ||
| △ |
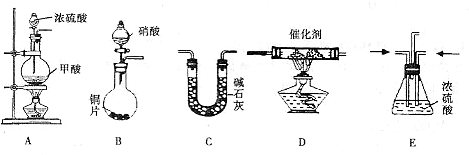
 ( )→( )→( )→收集气体
( )→( )→( )→收集气体| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
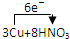 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O 2NH3(g);△H=-92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
2NH3(g);△H=-92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:

氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是 (填序号)。
A.向生石灰中滴入浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20 M Pa~50 M Pa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。


图Ⅰ 图Ⅱ
① 用滴定管盛氨水前,滴定管要用 润洗2~3遍,
② 试计算该种氨水的浓度: 。
③ 下列情况下,会导致实验结果c(NH3·H2O)偏低的是 。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
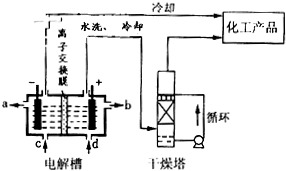
(4) 1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。

正极的电极反应式为: 。
| ||
| ||
| △ |
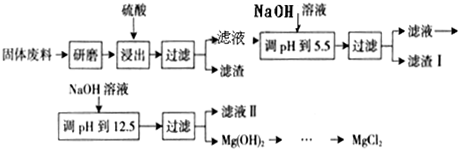
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
(本题16分)Ⅰ。某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
Ⅱ。饱和的NaHSO3溶液可以与醛发生加成反应,生成水溶性的α-羟基磺酸钠。发生的反应为:
R-CHO + NaHSO3 R-CH(OH)SO3Na
R-CH(OH)SO3Na
反应是可逆的,在通常条件下有70%--90%向正反应方向转化。
(4)利用Ⅰ中装置制取少量NaHSO3溶液,应采取措施,将装置进行部分改变。这种措施是:_____________________________________________________________________;确认有NaHSO3生成的现象是:_______________________________________.
(5)若溴苯中混有杂质乙醛,欲将此杂质除去,可采用的试剂是:__________,其分离的方法是:_____________________.
(6)若在CH3-CH(OH)SO3Na 水溶液中加入足量盐酸,有机物转化为:___________,将该转化产物分离出来的方法常用__________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com