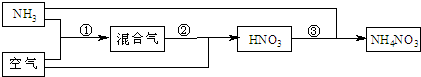
(2011?宁波模拟)一种“人工固氮”的新方法是在光照条件下,N
2在催化剂表面与水蒸气发生反应生成NH
3和氧气. 已知:
| 化学键 |
N≡N |
H-O |
N-H |
O=O |
| 键能/kJ?mol-1 |
945 |
463 |
391 |
498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:
N
2(g)+3H
2O(g)

2NH
3(g)+
O
2(g);△H=+630kJ?mol
-1N
2(g)+3H
2O(g)

2NH
3(g)+
O
2(g);△H=+630kJ?mol
-1;
(2)进一步研究NH
3生成量与温度的关系,部分实验数据见下表(反应时间3h):
| T/℃ |
30 |
40 |
50 |
| 生成NH3量/(10-6mol/L) |
4.8 |
5.9 |
6.0 |
①50℃时从开始到3h内以O
2物质的量浓度变化表示的平均反应速率为
1.5×l0-6mol/(L?h)(或2.5×l0-8mol/(L?min)
1.5×l0-6mol/(L?h)(或2.5×l0-8mol/(L?min)
;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH
3生成量的建议(请写出两条)
升高温度
升高温度
、
增大压强
增大压强
;
(3)氨是氮肥工业的重要原料.某化肥厂生产铵态氮肥(NH
4)
2SO
4的工业流程如下:
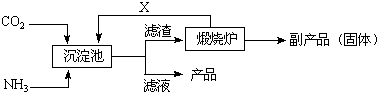
①往沉淀池中装入CaSO
4悬浊液后,需先通入足量NH
3,再通入CO
2的原因是
氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4
氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4
.
②煅烧炉中产生的固态副产品为
CaO(或生石灰)
CaO(或生石灰)
,生产流程中能被循环利用的物质X为
CO2(或二氧化碳)
CO2(或二氧化碳)
.

 2NH3(g)+
2NH3(g)+ 2NH3(g)+
2NH3(g)+