氮化镁“跑”到哪儿去了
小李老师发现,在空气中直接点燃镁条,根本观察不到镁与氮气反应的现象,产物中也检验不出氮化镁.生成的氮化镁究竟“跑”到哪儿去了?于是,他对该问题进行了探究.
1、仪器、药品
仪器:水槽、钟罩(内径15厘米、容积约为2300毫升)、
、单孔塞、粗铜丝、小试管、蒸发皿(直径9.3厘米)
药品:镁条、蒸馏水、红色石蕊试纸
2、仪器装置
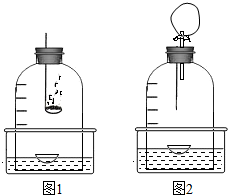
3、步骤、现象
(1)如图1所示,将一蒸发皿浮于水面,通过燃烧的红磷除去钟罩内的氧气,待充分冷却,观察到钟罩内的水面上升了原水面上方容积的1/5,得到了较为纯净的氮气.
(2)往水槽内慢慢注水,使钟罩内外水面持平.
(3)在一单孔塞上固定一家用保鲜薄膜袋,另一端插入一粗铜丝,铜丝下端悬挂一约25厘米长绕成螺旋状的光亮的镁条.
(4)如图2所示,点燃镁条,同时拔出插有燃烧匙的塞子,立刻将燃烧着的镁条伸入钟罩内,并塞紧单孔塞.可观察到镁条与刚混入的少量氧气剧烈反应,冒出大量的白烟,发出耀眼的白光,放出的热使钟罩内的气体体积迅速膨胀,一会儿光的强度在减弱,变成了红光.
(5)燃烧停止后,钟罩内的水面立刻上升,上端的内壁出现淡黄色粉未(氮化镁
所致).
(6)打开单孔塞,移走钟罩,把蒸发皿内的灰分转移至小试管内,加入1毫升蒸馏水,在试管口平放一湿润的红色石蕊试纸,加热到沸腾,可观察到红色石蕊试纸变蓝,反应方程式为:Mg
3N
2+6H
2O?3Mg(OH)
2↓+2NH
3↑.
认真阅读以上材料,并回答以下问题:
①小李老师在装置中选用的是小气球还是家用保鲜袋?理由是什么?
②用什么词代替符号②,可以对氮化镁出现在钟罩内壁上端的现象作出解释?
③实验步骤(2)中,为什么要“往水槽内慢慢注水,使钟罩内外水面持平”?
④有人认为“Mg
3N
2在800℃时可分解成Mg和N
2,Mg燃烧的火焰温度高于800℃,那么即使有Mg
3N
2生成,生成的Mg
3N
2也会分解,即燃烧的最终产物是MgO”;有人在理论上计算出“在500℃时,生成氧化镁与氮化镁的质量之比为10
8:1”.那么,请你谈谈“在空气中直接点燃镁条,根本观察不到镁与氮气反应的现象,产物中也检验不出氮化镁”的原因.

 如图是空气中氧气含量的测定装置.试回答:
如图是空气中氧气含量的测定装置.试回答: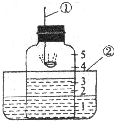 如图所示,用此装置测量空气中氧气的含量,在燃烧匙中加入红磷,红磷与空气中的氧气发生化学反应生成五氧化二磷固体,请按要求填空.
如图所示,用此装置测量空气中氧气的含量,在燃烧匙中加入红磷,红磷与空气中的氧气发生化学反应生成五氧化二磷固体,请按要求填空.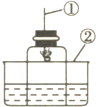 如图所示,用此类装置测量空气中氧气的含量.在燃烧匙中加入红磷,红磷与空气中的氧气发生化学反应生成五氧化二磷固体,请按要求填空.
如图所示,用此类装置测量空气中氧气的含量.在燃烧匙中加入红磷,红磷与空气中的氧气发生化学反应生成五氧化二磷固体,请按要求填空. 氮化镁“跑”到哪儿去了
氮化镁“跑”到哪儿去了 氮化镁“跑”到哪儿去了
氮化镁“跑”到哪儿去了