
题目列表(包括答案和解析)
(10分)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A的离子结构示意图是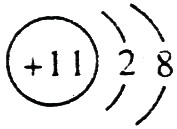 ,C的原子结构示意图是
,C的原子结构示意图是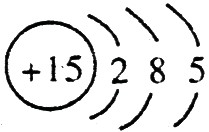 。
。
(2)C的最高价氧化物对应的水化物与A的氢氧化物生成三种盐,化学式分别为Na3PO4、Na2HPO4、NaH2PO4。
(3)C、D的气态氢化物稳定性由强到弱的顺序是 HCl>PH3。
【解析】 最高正价=原子最外层电子数,B元素的原子最外层电子数应为4,B元素原子的次外层电子数为2,为K层,B元素原子核外共有2+4=6个电子,B是6号元素碳;A、C原子次外层电子数为8,则A、C原子核外电子数分别是:2+8+1=11和2+8+5=15,所以A为11号元素钠,C为15号元素磷;在1~18号元素中,最高价为+7的只有氯元素(F无正价),而HClO4是已知含氧酸中最强的酸,故D为氯。
(1)钠总是+1价,其离子结构示意图为: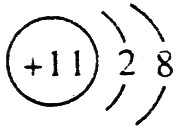 ;磷的原子序数是15,其原子结构示意图是:
;磷的原子序数是15,其原子结构示意图是: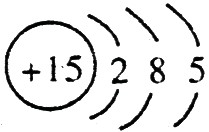 。
。
(2)磷的最高价(+5)氧化物对应的水化物是H3PO4,与NaOH反应生成:Na3PO4、NaH2PO4三种盐。
(3)P、Cl原子都具有3个电子层,核电荷数P(15)小于Cl(17),原子半径r(P)>r(Cl),所以非金属Cl>P,气态氢化物稳定性HCl>PH3。
(1)其原子半径大小关系是:D>E>B>C>A;
(2)A、D同主族并可形成离子晶体DA;
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。 请填写下列空白:
①B、E两者的最高价氧化物对应的水化物反应后所得产物的溶液的pH________7(填“>”“<”或“=”);
②D
③1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生______mol A2气体,并写出其反应的离子方程式________________;
④BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为_______________。
A、B、C、D、E为短周期元素,其原子序数依次增大。其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3 :2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲。A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。请回答:
(1)写出B元素在周期表中的位置 ,C单质的电子式是____________。
(2)A、D、E组成的化合物乙与氯化亚铁溶液反应的实验现象为 。
(3)常温下,甲的水溶液pH_______7(填>、<或=),其原因是(用离子方程式表示)_____________________。
(4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙 :丙= 。
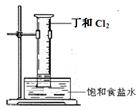
(5)A和B组成化合物丁,其相对分子质量为16。将右图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象。油状液滴的成分可能是(写分子式) 。
A、B、C、D、E、F六种的转化关系如右图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应。X、Y属于同一周期,且核电荷数相关4。
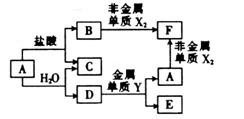
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型: ;D的化学式为 ;元素X、Y的原子半径大小顺序是 (用元素符号表示)。
(2)E与NaOH溶液反应的离子方程式为 。
(3)反应A+H2O→C+D的化学方程式为 。
(4)F能促进H2O的电离,其原因是 (用离子方程式表示)。
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH= 。
(14分)A、B、C、D、E、F六种的转化关系如右图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应。X、Y属于同一周期,且核电荷数相差4。
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型: ;D的化学式为 ;元素X、Y的原子半径大小顺序是 (用元素符号表示)。
(2)E与NaOH溶液反应的离子方程式为 。
(3)反应A+H2O→C+D的化学方程式为 。
(4)F能促进H2O的电离,其原因是 (用离子方程式表示)。
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com