
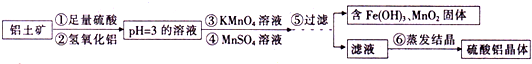
题目列表(包括答案和解析)
滴定次数 |
0.05000mol?L-1Na2S2O3标准溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | |
| 1 | 0.00 | 20.04 |
| 2 | 0.12 | 20.08 |
| 3 | 0.05 | 20.05 |
一般情况下,当人体一次性摄取300 mg~500 mg亚硝酸钠时,就会引起中毒.某研究小组用碘量法测定泡菜中亚硝酸盐的含量.有关反应如下:
2NaNO2+2H2SO4+2KI===2NO↑+I2+K2SO4+Na2SO4+2H2O
2Na2S2O3+I2===Na2S4O6+2NaI
取1 kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使泡菜汁中的亚硝酸盐都成为亚硝酸钠.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至1 L,取25.00 mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,再选用合适的指示剂,用0.05000 mol·L-1Na2S2O3标准溶液进行滴定.实验数据记录如下:
| 滴定次数 | 0.050 00 mol·L-1 Na2S2O3标准溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | |
| 1 | 0.00 | 20.04 |
| 2 | 0.12 | 20.08 |
| 3 | 0.05 | 20.05 |
一般情况下,当人体一次性摄取300 mg~500 mg亚硝酸钠时,就会引起中毒.某研究小组用碘量法测定泡菜中亚硝酸盐的含量.有关反应如下:
2NaNO2+2H2SO4+2KI===2NO↑+I2+K2SO4+Na2SO4+2H2O
2Na2S2O3+I2===Na2S4O6+2NaI
取1 kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使泡菜汁中的亚硝酸盐都成为亚硝酸钠.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至1 L,取25.00 mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,再选用合适的指示剂,用0.05000 mol·L-1Na2S2O3标准溶液进行滴定.实验数据记录如下:
|
滴定次数 |
0.050 00 mol·L-1 Na2S2O3标准溶液体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
|
|
1 |
0.00 |
20.04 |
|
2 |
0.12 |
20.08 |
|
3 |
0.05 |
20.05 |
请回答下列问题:
(1)该实验中可选用的指示剂是________,滴定终点的现象是________.
(2)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害.这主要是因为橙汁中含有丰富的维生素C,维生素C具有________性(填“氧化”或“还原”).
(3)通过计算判断若某人一次食入0.125 kg这种泡菜,是否会引起中毒?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com