
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构式意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。完成下列问题:
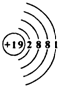
(1)钾的原子核外有19个电子,画出钾的原子结构式意图_____________。
(2)预测钾的化学性质,完成下列反应的化学方程式,并进行实验验证
①钾在氯气中燃烧_______________________________________。
②点燃钾剧烈燃烧_______________________________________。
③将小块钾投入冷水中_______________________________________。
(3)推测钾在自然界中的存在方式是_____________(填“游离态”或“化合态”)。
(4)该小组研究钾的性质时用到了哪些主要方法:_______________________________________。
他们是按照怎样的程序来研究金属钾的性质的: 。
氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制 实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4滴∽6滴,振荡即成。这样操作的目的是 。
下面是三个研究性学习组分别从不同层面开展研究性学习活动:
(2)研究性学习小组甲:对教材实验结论"乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O"提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想: 。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。你认为合理的方案是 。
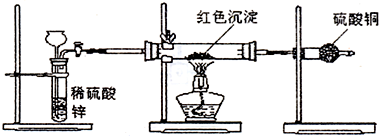
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量: 。

①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,"2005年诺贝尔化学奖授予了三位研究绿色化学的科学家"。绿色化学强调对环境友好,实现零排放。"变废为宝"符合绿色化学要求。他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com