
题目列表(包括答案和解析)
元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律
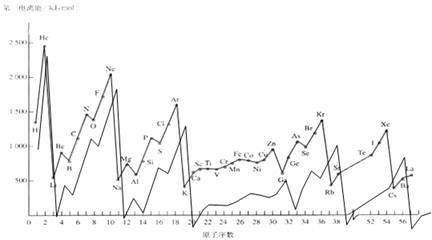
例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
(2)
| Li | Na | K | |
| 熔点 | 180 | 98 | 63 |
| 沸点 | 1347 | 881 | 756 |

根据以上三个图表回答:(M表示碱金属)
△H2(Li) △H2(Na), △H3(Li) △H3(Na),
已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律

例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
(2)
| Li | Na | K | |
| 熔点 | 180 | 98 | 63 |
| 沸点 | 1347 | 881 | 756 |

根据以上三个图表回答:(M表示碱金属)
△H2(Li) △H2(Na), △H3(Li) △H3(Na),
已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
(12分)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
⑴第四周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
⑵第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
⑶用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
⑷Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
①Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
②CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) 。
(12分)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
⑴第四周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
⑵第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
⑶用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
⑷Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
①Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
②CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com