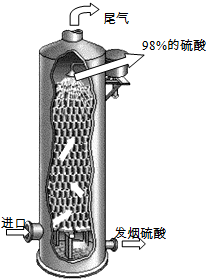
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS
2)为原料生产硫酸.
| 成分 |
催化氧化前 |
催化氧化后 |
| O2 |
11% |
未测定 |
| SO2 |
7% |
未测定 |
| N2 |
82% |
84.8% |
| SO3 |
-- |
6.9% |
(1)SO
2的催化氧化是硫酸工业的主要反应.现有标准状态下5.6L SO
2气体,在500℃、V
2O
5催化下转化成SO
3,若SO
2转化率为a%,放出热量为QkJ.该反应的热化学方程式为
2SO
2(g)+O
2(g)?2SO
3(g)△H=-
kJ/mol
2SO
2(g)+O
2(g)?2SO
3(g)△H=-
kJ/mol
.
(2)已知在SO
2催化氧化前后混合气体中各成分的体积分数如表,则SO
2的转化率为
95.3%
95.3%
.
(3)如图所示,用98%的浓硫酸1.0t吸收SO
3制得发烟硫酸(化学组成可表示为H
2SO
4?xSO
3),可生产SO
3质量分数为20%的发烟硫酸
1.36
1.36
t.
(4)某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品充分灼烧,生成的SO
2气体与足量Fe
2(SO
4)
3溶液完全反应后,再用0.02000mol?L
-1的K
2Cr
2O
7标准溶液滴定至终点,消耗K
2Cr
2O
7溶液25.00mL.
已知:SO
2+2Fe
3++2H
2O=SO
42-+2Fe
2++4H
+Cr
2O
72-+6Fe
2++14H
+=2Cr
3++6Fe
3++7H
2O
则样品中FeS
2的质量分数是多少?(假设杂质不参加反应)
.

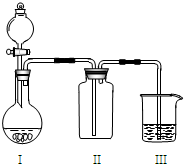 实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是( )
实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是( )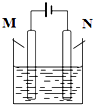 如图所示,用石墨作电极电解氯化铜溶液,下列说法正确的是( )
如图所示,用石墨作电极电解氯化铜溶液,下列说法正确的是( )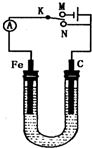 如图所示,用铁棒和石墨棒作电极电解1L 1mol/L的食盐水,下列有关说法正确的是( )
如图所示,用铁棒和石墨棒作电极电解1L 1mol/L的食盐水,下列有关说法正确的是( ) (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.