
题目列表(包括答案和解析)
(9分)
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
|
滴定次数 |
待测NaOH溶液的体积/mL |
0.1000 mol/L盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
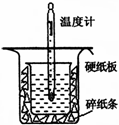
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com