
题目列表(包括答案和解析)
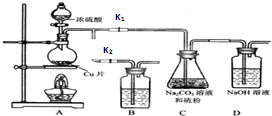 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
| ||
| ||
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
| 改变的条件 | 平衡移动的方向 | 平衡移动的过程 |
| 增大反应物的浓度 | 正向移动 正向移动 |
反应物的浓度 减小 减小 |
| 减小压强 | 向气体体积增大方向移动 向气体体积增大方向移动 |
体系的压强逐渐 增大 增大 |
| 升高温度 | 向吸热方向移动 向吸热方向移动 |
体系的温度逐渐 降低 降低 |
| 使用合适的催化剂 | 平衡不移动 平衡不移动 |
速率 加快 加快 达平衡所需时间 缩短 缩短 |
 .
. 填上反应产物
填上反应产物(10分)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:
(1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2 。写出该反应的化学方程式: 。
(2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应: —
— 
①配平上面的氧化还原反应方程式.将化学计量数填入方框中。
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘单质是 mol。
(3) 向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是
| A.BaSO4 | B.FeS | C.BaSO3 | D.S |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com