
题目列表(包括答案和解析)
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g)  CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
已知:CO(g) + H2O(g)  CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g)  CH3CH2OH(g) +3H2O(g)
△H = 。
CH3CH2OH(g) +3H2O(g)
△H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
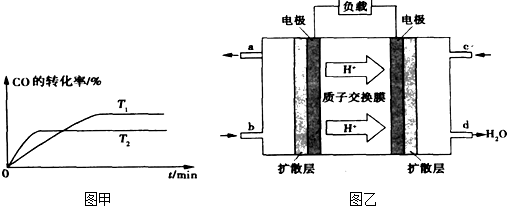
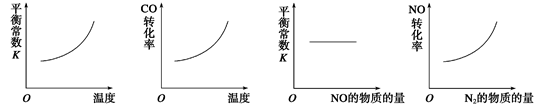
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。

②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g)
 N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol∙L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。

| 通电 |
| 加热 |
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO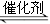 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
|
时间(s) |
0 |
2 |
4 |
|
c(NO) ( mol·L-1) |
1.00×10-3 |
2.50×10-4 |
1.00×10-4 |
|
c(CO) ( mol·L-1) |
3.60×10-3 |
c’ |
2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
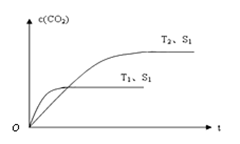
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是

A. B. C. D.
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com