
题目列表(包括答案和解析)

| △ |
| △ |


(1)在抗击“禽流感”斗争中,消毒液需求量猛增。利用如右图装置制备消毒液:电解氯化钠溶液制取“84”消毒液,氯气被完全吸收,则对电极名称和消毒液的主要成分判断正确的是( )
A.a为正极,b为负极;NaClO和NaCl B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl D.a为阴极,b为阳极;HClO和NaCl
(2)适当改变电极也可用上图装置制取氢氧化亚铁。通电后,溶液中产生大量白色沉淀,且较长时间不变色。下列说法中正确的是( )
A.电源中的a一定为正极,b一定为负极
B.不能使用氯化钠溶液作电解液
C.A、B两端都必须使用铁作电极
D.B电极发生的反应可能是:2H2O+2e-![]() H2↑+2OH-
H2↑+2OH-
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
2NH3 + 3CuO ![]() 3Cu + N2 +3H2O
3Cu + N2 +3H2O
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应,如Cu2O(红色)会生成Cu2+和Cu:
Cu2O + 2H+ == Cu2+ + Cu +H2O

请回答下列问题:
(1)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是 ;
(2)当观察到 (填现象),即表明A中的反应已经完成;
(3)该小组欲用体积比为1︰4的稀硫酸做试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1︰4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 ;
(4)可证明还原产物中含有Cu2O的操作及现象是 ;
(5)请写出A中生成Cu2O的化学方程式 ;
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是
。
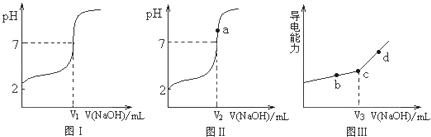
(12分)某研究性学习小组利用手持技术探究强碱和不同的酸中和反应的过程如下:
(1)实验步骤:
①分别配制浓度均为0.1mol·L-1的NaOH、HC1、CH3 C00H、H3PO4溶液备用。配制过程中用到的玻璃仪器有烧杯、容量瓶、玻璃棒、细口瓶、____、____。
②在锥形瓶中加入10mL0.1 mol.L-1的HC1,在25.00mL____(填“酸式”、“碱式”)滴定管中加入0.1 mol.L-1的NaOH,连接数据采集器和pH传感器。
③向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④存储计算机绘制的pH变化图。用0.1 mol·L-1的CH3 C00H、H3 P04溶液代替HC1重复上述②~④的操作。
(2)结果分析:20℃时NaOH分别滴定HC1、CH3 C00H、H3 P04的pH变化曲线如下。
根据上述曲线回答下列问题:
①20℃时,三种酸从强到弱的顺序是 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
③醋酸恰好中和时pH≈8的原因是 ;
④你认为前述的步骤中,NaOH滴定磷酸是否可行? (填“可行”、“不可行”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com