
题目列表(包括答案和解析)
(每空2分,共12分)键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
|
化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低? (填“能”或“不能”),原因是 。
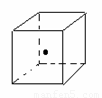
(3)如图立方体中心的“· ”表示金刚石晶体中的一个原子,请在立方体的顶点用“· ”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________。
(共12分)碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-==2SO42- +I2(慢) I2+2 S2O32-==2I- +S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的__________耗尽后,溶液颜色将由无色变成为蓝色。为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)_______。

(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx=_______________mL,理由是___________________。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应地标注)

(4)碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)=2LiI(s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H=_______________。
(本题共12分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;54 g D的单质跟足量盐酸反应,生成D3+和67.2 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。

①B、D的最高价氧化物对应水化物相互反应的离子方程式为: 。
②用电子式表示C与E形成E2C的过程: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为 。
②在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,反应离子方程式是__________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
(本题共12分)海水中有丰富的卤素资源,含量最高的食盐(NaCl)不但是人类生活不可缺少的物质,而且是重要的化工原料。
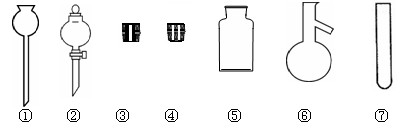
(1).实验室里常用NaCl制取HCl。请在下图中选择合适的仪器用于发生HCl气体:
(填写仪器编号)。
(2).在实验室里使用与制取HCl相同的实验装置和条件,将浓硫酸滴入NaBr(s),可以观察到的现象是 。
(3).产生上述现象的原因是 。
(4).收集HCl(g)和HBr(g)的实验时不可缺少的实验操作是: 。
(5).除水之外,限用 HCl(g)、HBr(g)和HI(g),还需要 (填写试剂的化学式),就能设计实验比较氯、溴、碘的化学活泼性。
(6).工业上可用食盐作为一种主要原料,经不同的方法生产纯碱。联合制碱法(侯氏制碱法)与氨碱法(索氏制碱法)相比,其优点是: 、 和避免产生大量含CaCl2的废液。
(本题共12分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;54 g D的单质跟足量盐酸反应,生成D3+和67.2 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①B、D的最高价氧化物对应水化物相互反应的离子方程式为: 。
②用电子式表示C与E形成E2C的过程: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为 。
②在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,反应离子方程式是__________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com