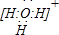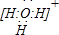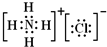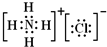Ⅰ.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是
sp3
sp3
,分子空间构型为
三角锥
三角锥
,其电子式为
.
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为
,其中心原子的杂化类型为
sp3
sp3
,VSEPR模型空间构型为
四面体型
四面体型
.
(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程
(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
丙烷
丙烷
,A、B、D元素的原子也可以共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式
CO2+CO32-+H2O═2HCO3-
CO2+CO32-+H2O═2HCO3-
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO
3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
Fe、26
Fe、26
、Y
Cr、24
Cr、24
Z
Ni、28
Ni、28
.
(6)请写出Z的原子核外电子排布式
[Ar]3d84s2
[Ar]3d84s2
,X元素在周期表中的位置
第四周期第Ⅷ族
第四周期第Ⅷ族
.